|
 |
|||||||||||||||
|
||||||||||||||||
Норма атипичных мононуклеаров у ребенкаАтипичные мононуклеары в крови у ребенка: норма и причины отклоненийВсем родителям известно, что в крови ребенка присутствуют такие клетки, как эритроциты и лейкоциты, а также тромбоциты. Многие мамы также знают, что лейкоциты представлены разными видами, а определение их уровня в процентах составляет лейкоцитарную формулу. Все эти клетки находятся в кровотоке ребенка в норме. Однако помимо нормальных клеток в анализе крови детей могут появляться и измененные, подсказывая родителям и врачам, что у ребенка имеется определенная болезнь. Одними из таких измененных клеток крови выступают атипичные мононуклеары. Посмотрите интересное видео, в котором знаменитый детский доктор Комаровский подробно разъясняет, что такое клинический анализ крови: Что это
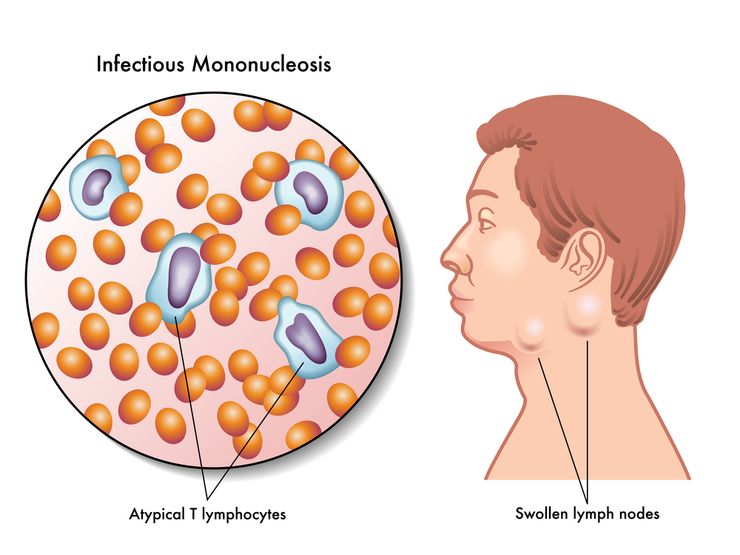
В атипичных мононуклеарах есть одно ядро, которое отличается полиморфизмом и губчатой структурой. Форма таких клеток является круглой или овальной. В зависимости от состава цитоплазмы и размеров эти клетки делят на моноцито- и лимфоцитоподобные. По мнению многих ученых, атипичные мононуклеары происходят от Т-лимфоцитов. Они вырабатываются в ответ на проникновение вирусов в детский организм или под влиянием других факторов. Как определяют у детейВыявление атипичных мононуклеаров в детском возрасте происходит во время проведения клинического анализа крови, включающего лейкограмму. Такие клетки подсчитываются в анализируемом объеме крови, сравниваются с числом всех лейкоцитов и выражаются в процентах. Ребенка направляют на такой анализ:
НормаВ нормальном анализе крови ребенка атипичных мононуклеаров зачастую нет, но присутствие единичных клеток такого типа не считается патологией, поэтому нормой для детского возраста называют 0-1% вироцитов от числа всех белых клеток крови. Причины повышенного уровняНаиболее часто уровень атипичных мононуклеаров повышается при вирусных заболеваниях, например, при ветряной оспе. Повышенный процент вироцитов также выявляют при:
Следует отметить, что в большинстве случаев такие клетки не превышают 10% от всех лейкоцитов. Если же атипичных мононуклеаров в лейкоцитарной формуле анализа крови детей выявляют больше десяти процентов, это является поводом диагностировать у ребенка болезнь под названием «инфекционный мононуклеоз». Поскольку ее причиной является вирус Эпштейна-Барр, такое заболевание также называют ВЭБ-инфекцией. При такой инфекции атипичные мононуклеары выявляются в крови ребенка всегда. Болезнь чаще диагностируют у детей старше года, а ее инкубационный период может составлять до двух месяцев, а заразиться можно как при прямом контакте с болеющим ребенком, так и воздушно-капельным путем. При данной патологии уровень атипичных мононуклеаров может достигать 50% от всех лейкоцитов, а в некоторых случаях даже бывает выше.
Что делать при большом уровне в кровиЕсли анализ крови ребенка показал высокое содержание атипичных мононуклеаров, это является поводом обращения к врачу. Педиатр оценит общее состояние малыша, а также перенесенные болезни, поскольку после недавней вирусной инфекции уровень вироцитов в крови бывает повышенным еще несколько недель. Подтвердив наличие у ребенка ВЭБ-инфекции, ему назначат симптоматическую терапию, включающую жаропонижающие, общеукрепляющие, антисептические и другие препараты. Специфического лечения, воздействующего на вирус Эпштейна-Барр, не существует.
При поражении печени ребенка переводят на специальную щадящую диету, дополняя ее лекарствами с гепатопротекторным и желчегонным действием. Если присоединилась бактериальная инфекция, показано применение антибиотиков и пробиотиков. При тяжелом течении или осложнениях ребенку могут назначаться гормональные средства, удаление селезенки, трахеостомия или искусственная вентиляция легких. Норма мононуклеаров в крови у ребенка: уровень мононуклеаровКровь в организме ребенка представлена жидкой частью и несколькими типами клеток. Среди них встречаются нормальные и патологические клетки. Услышав, что в анализе крови малыша обнаружены мононуклеары, родители в первую очередь думают о болезни, но являются ли эти клетки патологическими или могут присутствовать в норме? Что этоТермин «мононуклеары» употребляют по отношению ко всем клеткам крови, у которых есть одно ядро. Их представителями являются моноциты и лимфоциты. Внутри мононуклеаров отсутствуют гранулы, поэтому их также называют агранулоцитами. Лимфоциты в теле ребенка отвечают за иммунные реакции.
Моноциты, также называемые мононуклеарными фагоцитами, не менее важны для иммунитета. Преобразуясь в макрофаги, эти клетки способны поглощать бактерии и вирусы, а также передавать сигналы лимфоцитам о появлении «врага» в детском организме. Когда и как определяют мононуклеарыОдноядерные клетки крови определяют во время проведения общего анализа крови ребенка, когда расшифровывается лейкоцитарная формула. В такой формуле указывается процентное содержание всех лейкоцитов, включая моноциты и лимфоциты. Оценка их уровня важна в таких ситуациях:
Норма мононуклеаровВ анализе крови детей младше пяти лет моноциты в норме составляют лишь от 4 до 10% от всех белых кровяных телец. С 5-летнего возраста нормальным процентом моноцитов в лейкограмме ребенка считают 4-6%, а с 15-летнего – 3-7%. Что касается лимфоцитов, то сразу после рождения они составляют 16-32% от всех лейкоцитов, но уже к пятому дню жизни повышаются до 40-60%, оставаясь на таком уровне первые годы жизни. Их число превышает процент всех других лейкоцитов до 5-летнего возраста, когда лимфоцитов насчитывается 35-55%. Затем их уровень немного снижается, составляя в норме у детей старше 10 лет от 30 до 45% от всего числа белых клеток крови. Рекомендуем посмотреть выпуск программы Елены Малышевой "Жить здорово!", в котором освещается тема лейкоцитарной формулы: Изменение уровня мононуклеаровПричинами изменения числа моноцитов в крови ребенка являются: Изменение уровня лимфоцитов в крови детей бывает вследствие таких причин: Атипичные мононуклеарыПомимо нормальных для анализа крови ребенка клеток, к которым относят моноциты и лимфоциты, при заболеваниях среди них могут появляться и патологические мононуклеары, называемые также атипичными или вироцитами. Такие клетки представляют собой видоизмененные одноядерные клетки крови. В норме их содержание в крови ребенка составляет 0-1%, а увеличение наблюдается при вирусных инфекциях. Также небольшое повышение вироцитов возможно при аутоиммунных процессах, опухолях или после проведения вакцинации. Однако в таких случаях уровень этих клеток редко превышает 10%. Наиболее высокий уровень атипичных мононуклеаров диагностируют при инфекционном мононуклеозе. Эту болезнь вызывает вирус Эпштейна-Барр, поэтому такая болезнь также называется ВЭБ-инфекцией. Выявление вироцитов в крови детей в количестве более 10% является одним из диагностических признаков, подтверждающих наличие у пациента инфекционного мононуклеоза. Иногда белые клетки крови ребенка с ВЭБ-инфекцией состоят из атипичных мононуклеаров более чем на 50%. Стоит также отметить, что в течение нескольких недель после выздоровления уровень вироцитов у ребенка, перенесшего инфекционный мононуклеоз, будет оставаться повышенным. Атипичные мононуклеары в крови у ребенка: норма, причины повышения, лечениеАтипичные мононуклеары или, как их еще называют, вироциты — особые клетки крови, которые по своей структуре сильно напоминают моноциты. Они предназначены для борьбы с вирусными агентами, попадающими в организм. Являются диагностическим критерием инфекционного мононуклеоза.  Атипичные мононуклеары в крови у ребенка - признак мононуклеоза Почему появляются атипичные мононуклеары в крови ребенка?Когда ребенок полностью здоров, вироциты в его анализах присутствовать не будут, за исключением редких случаев. Таким образом, норма данного показателя — единичные в поле зрения. Причинами, по которым вироциты выявляются в анализе, могут стать следующие вирусы:
Если концентрация атипичных мононуклеаров в крови ребенка не достигает 10%, это свидетельствует только о том, что в организме начинает развиваться вирусная инфекция. Когда уровень вироцитов превышает этот показатель, можно с высокой вероятностью предполагать инфекционный мононуклеоз. Инфекционный мононуклеоз у детейЗаболевание вызывается вирусом Эпштейна-Барра, относящимся к семейству герпесвирусов. Основной мишенью вируса становятся В-лимфоциты. Источником инфекции является не только больной человек, но и носитель, у которого наличие в организме возбудителя не привело к развитию заболевания. Как и другие вирусные инфекции, мононуклеоз передается воздушно-капельным путем. Инкубационный период может продолжаться несколько от нескольких недель, до нескольких месяцев. СимптомыЗаболевание не всегда начинается остро. Также может протекать в подострой и хронической форме. Для стадии обострения характерны следующие проявления:
Проявления со стороны нервной системы отмечаются при тяжелых формах мононуклеоза, которые не поддаются классическому лечению. ДиагностикаДля выявления заболевания необходимо проведение следующих обследований: ИФА и ПЦР используются для поиска следов возбудителя в крови пациента. Они являются наиболее информативными. В биохимическом анализе отмечается билирубинемия, а в общем анализе крови может быть увеличено количество вироцитов. Они будут повышены в диапазоне от 10 до 55% в зависимости от тяжести инфекции. Для выявления осложнений заболевания можно воспользоваться УЗИ, рентгенографией пазух и грудной клетки. Дифференциальный диагноз мононуклеоза проводится со всеми инфекционные заболеваниями, сопровождающимися синдромом сыпи. ЛечениеТерапия мононуклеоза должна быть комплексной и включать в себя ряд препаратов. Основную роль играют противовирусные средства, в частности интерфероны и ацикловир. Оба средства имеют хорошую доказательную базу. При осложнении заболевания необходимо подключение антибактериальных средств. Препаратами выбора в этом случае будут антибиотики из группы фторхинолонов и цефалоспоринов. При инфекционном мононуклеозе запрещается применять следующие средства: Важно помнить, что перед началом лечебных мероприятий необходимо в обязательном порядке получить консультацию специалиста. ОсложненияПри данном заболевании осложнения развиваются крайне редко. К ним можно отнести следующие:
Еще одним серьезным осложнением является то, что вирус Эпштейна-Барр является онкогенным. Это значит, что он может становится причиной появления новообразований. В частности, повышается риск развития лимфом.  Инфекционный мононуклеоз: норма атипичных клеток Атипичные мононуклеары в крови у ребенка — показатель, который свидетельствует о наличии в организме инфекционного мононуклеоза или иной вирусной патологии. При данном заболевании может быть достаточно разнообразная клиническая картина, схожая со многими патологиями. Именно поэтому анализ крови на мононуклеары является такой важной процедурой. Также интересно почитать: нефробластома у детей Атипичные мононуклеары : причины появления и морфологияАтипичные мононуклеары у детейВироциты могут возникать в крови у пациентов любого возраста. Атипичные мононуклеары у детей указывают на вирусное заболевание – мононуклеоз. Недуг возникает из-за вируса Эпштейна-Барра, который поражает паренхиматозные органы и клетки лимфоидной ткани. Инфекционный процесс локализуется в глотке, печени и селезенке. Атипичные клетки появляются при ветряной оспе, так как вирус относится к тому же роду, что и возбудитель мононуклеоза. Его действие снижает защитные свойства иммунной системы, открывая дорогу для других патологий. Чаще всего атипичные мононуклеары обнаруживают у детей 8-10 лет. Это связано с тем, что данная возрастная категория подвержена многим инфекционным заболеваниям. Меньше всего болеют дети до 1 года, в данном возрасте обнаруживают около 0,5% всех случаев мононуклеаров. Инфекция передается воздушно-капельным путем, при контакте между детьми, но она неустойчива к окружающей среде. Симптомы атипичные мононуклеаров у детей:
В редких случаях на теле ребенка появляются высыпания петихиального характера (без определенной локализации) и желтушное окрашивание кожи. Согласно медицинской статистике, чаще всего вирус обнаруживают у мальчиков, пик заболеваемости приходится на осенне-зимний и весенний период. Вредоносные микроорганизмы попадают на слизистую оболочку верхних дыхательных путей и распространяются по всему организму, поражая лимфатические узлы, печень и селезенку. Инкубационный период занимает от 5 до 15 дней. Для восстановления нормального уровня вироцитов в крови, проводится симптоматическая и общеукрепляющая терапия, которые направлены на устранение признаков заражения. Антибиотики не используются, так как они не воздействуют на вирус. Лечебными свойствами обладают витамины группы В, С, Р. [12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23] Морфология атипичных мононуклеаровСтроение вирусных клеток во многом определяет механизм их действия и поражения организма. Морфология атипичных мононуклеаров указывает на то, что их возбудителем является вирус Эпштейна-Барр. Данные клетки относятся к герпес-вирусам, имеют сложное строение и содержат ДНК в виде двойной спирали. Вирус устойчив к низким температурам и высушиванию. Инфекция передается воздушно-капельным, контактным и гемоконтактным путями. Заболевание встречается в форме спорадических вспышек. Как правило, заражение диагностируют у детей дошкольного и школьного возрасту, преимущественно у мальчиков. Дети до одного года не болеют из-за пассивного иммунитета. Недуг является сезонным явлением, обострение наблюдается в зимне-весенний период. Болезнь не рецидивирует, смертность низкая, но имеются данные об единичных случаях разрыва селезенки, поражения ЦНС и стеноза гортани. Проникновение вируса осуществляется через слизистую оболочку верхних дыхательных путей и ротоглотки. Адгезия происходит с помощью рецепторов, которые расположены на поверхности клеток эпителия. Размножение вируса приводит к разрушению клеток, что вызывает выброс в кровь новых поколений инфекции. Атипичные мононуклеары являются инфицированными В-лимфоцитами с измененными функциональными и морфологическими свойствами. Патологические изменения в иммунной системе приводят к тому, что организм не способен полностью нейтрализовать вирус, который может пожизненно находится в латентной форме в В-лимфоцитах. Клетки морфологически сходные с атипичными мононуклеарамиПоскольку вироциты указывают на наличие инфекции в организме, то существуют и другие клеточные структуры с ними схожие. Лимфоциты являются клетками, морфологически сходными с атипичными мононуклеарами. Они подобны по форме и размеру ядра, цитоплазме. Их обнаруживают в крови при различных вирусных заболеваниях (краснуха, грипп, корь, ветряная оспа), аутоиммунных заболеваниях, аллергических реакциях, вакцинации и различных опухолях. Исходя из этого, различают два типа атипичных мононуклеаров: моноцитоподобные и лимфоцитоподобные. Лимфоцитоподобные отличаются от лимфоцитов тем, что имеют пенистую цитоплазму, им характерен полиморфизм ядра с губчатой структуры. То есть вироциты являются видоизмененными Т-лимфоцитами. В редких случаях обнаруживают клетки с гранулярной а-нафтилацетат зстеразой, не ингибируемой NaF. Вироциты имеют высокую активность кислой фосфатазы, лактата, а-глицерофоефата и дегидрогеназ сукцината. [24], [25], [26], [27], [28], [29] Анализ крови на атипичные мононуклеарыДиагностика вирусных и инфекционных заболеваний предполагает проведение различных исследований. Анализ крови на атипичные мононуклеары проводится при клинических симптомах мононуклеоза и схожих с ним болезней. Вироциты определяют с помощью общего анализа крови, который оценивает качественный и количественный клеточный состав, лейкоцитарную формулу, отношение объема плазмы и клеток, цветовые показатели и СОЭ. Видоизмененные Т-лимфоциты выявляют с помощью лимфоцитарной формулы (процентное соотношение различных видов лейкоцитов). Она используется для диагностики инфекционных, воспалительных и гематологических недугов, а также для оценки эффективности лечения. Мононуклеоз подтверждают в том случае, если в крови присутствует более 10% атипичных клеточных структур. [30], [31], [32], [33], [34] Атипичные мононуклеары при мононуклеозеПрисутствие вироцитов в крови указывает на инфекционное заболевание, вызванное вирусом Эпштейна-Барр. Атипичные мононуклеары при мононуклеозе, как правило, превышают порог в 10%. Инкубационный период точно не установлен, он варьируется от 5 до 21 дня, а в некоторых случаях до 1-2 месяцев. Болезнь начинается с резкого повышения температуры, воспаления шейных лимфоузлов, затруднения носового дыхания. Позже у больных можно пропальпировать увеличенную селезенку и печень. Если мононуклеоз имеет атипичную форму, то клиническая симптоматика смазана, поэтому недуг удается распознать только с помощью лабораторных анализов. Затяжные и хронические формы характеризуются гематологическими изменениями и лимфаденопатией, которые могут сохраняться в течение 4-6 месяцев. Критерием тяжести является выраженность синдрома интоксикации, длительность болезни и наличие осложнений. Атипичные мононуклеары в крови, требуют специфического лечения. Для терапии используют глюкокортикостероиды и витаминные комплексы. Антибиотики не применяются, так как они не оказывают воздейтсивя на вирус. Если в патологический процесс вовлечена печень, то больному назначают диетический стол №5а/№5. При отсутствии должного лечения, болезнь имеет плохой прогноз и грозит осложнениями. Чаще всего это неврологические нарушения, протекающие как асептический менингит, энцефалит и другие патологии. [35], [36], [37], [38], [39], [40], [41] норма в общем анализе, что значатКровь млекопитающего, а в частности человека, содержит в своем составе большое количество разнообразных клеток, каждая из которых выполняет определенную жизненно важную функцию. На эту особенность и опираются специалисты при расшифровке общего и других анализов крови. Если учесть, что с некоторыми видами кровяных телец практически все знакомы и знают, в чем заключается их деятельность, то определенные разновидности большинству внушают лишь недоумение. К одной из таких разновидностей относятся мононуклеарные клетки, то есть имеющие только одно ядро, так как являются молодыми. Еще их называют вироцитами, потому что основная их функция – обеспечение борьбы с вирусами, и появление подобных телец всегда связано с попаданием в организм инфекции. Иными словами, если анализ показал атипичные мононуклеары в крови у ребенка или взрослого, то однозначно речь идет о развитии заболевания вирусной природы. Подробно о мононуклеарахТермин «мононуклеары» используется по отношению ко всем кровяным тельцам, которые имеют только одно ядро. К ним относятся моноциты и лимфоциты. Внутри одноядерных клеток отсутствуют гранулы, из-за чего они составляют немногочисленную по сравнению с другими группу и называются агранулоцитами. Лимфоциты являются одной из разновидностей лейкоцитов – белых кровяных телец, и основная их функция – это обеспечение иммунитета. В зависимости от типа лимфоцитов их деятельность по отношению к патогенам может различаться. Они уничтожают вредоносный объект или возбудитель либо осуществляют продуцирование антител. Моноциты также относятся к мононуклеарным фагоцитам и играют важную роль для иммунитета. Трансформируясь в макрофаги (атипичные мононуклеары), они поглощают попавшие в организм вирусы и бактерии и транслируют остальным лимфоцитам сигналы о внедрении патогенных микроорганизмов. Атипичные мононуклеары в общем анализе крови – верный признак развития мононуклеоза инфекционной природы, хотя иногда они могут образовываться и при других вирусных патологиях. В отдельных ситуациях самая обычная вирусная инфекция может стать причиной повышения описываемых кровяных телец, но тогда их показатель не будет превышать 10%. Справка! Как правило, диагноз инфекционный мононуклеоз подтверждается при определении атипичных мононуклеаров в лейкоцитарной формуле более 10%. Нормальные показателиВ норме мононуклеары в крови детей младше 5 лет составляют 4-10% от всех кровяных телец, входящих в лейкоцитарную формулу. Затем показатель незначительно меняется. По наступлению 5-летнего возраста в лейкограмме ребенка определяются мононуклеары – 3-6%, а с 15 лет – 3-7%. Лимфоциты же претерпевают в процессе роста детей большие изменения – после рождения их доля равна 16-32% от всех белых телец, но при этом к 5 дню жизни они увеличиваются до 40-60% и на таком уровне остаются в первые годы жизни. До 5-ти лет лимфоциты являются самой многочисленной группой в лейкограмме, и количество их составляет 35-55%. Позже их численность немного падает и у детей старше 10 лет становится равна 30-45% от всего количества лейкоцитов. Когда появляются вироциты?У здорового человека атипичные мононуклеары полностью отсутствуют, и если они обнаруживаются при проведении общего анализа крови, то следует обязательно измерить их количество. Оно определяется путем процентного сопоставления выявленных вироцитов к общей численности лейкоцитов. В медицинской практике установлены общепринятые границы, благодаря которым удается подтвердить или опровергнуть наличие вирусной инфекции.  Основные характеристики моноцитов При содержании атипичных мононуклеаров меньше 10% можно утверждать, что в организме идет развитие вирусного заболевания, протекающего в острой форме. Безусловно, кроме расшифровки анализа потребуется консультация врача и тщательный осмотр пациента, что поможет выявить все присутствующие проявления заболевания. В отдельных случаях у здоровых людей отмечается незначительное повышение данных клеток. Поэтому, если указано в бланке атипичные мононуклеары 1% и не будет сопутствующей симптоматики, то лечение не потребуется. Единственное, что может порекомендовать врач, – это повторить анализ через определенное время в целях профилактики. Тогда как информация в протоколе исследования мононуклеары 5% уже не должна остаться без внимания, и пациенту в обязательно порядке придется пройти дополнительную диагностику. В норме уровень вироцитов в крови у взрослого, а также у ребенка не должен превышать 1%, и его повышение отмечается при внедрении вирусной инфекции. Поэтому показатель мононуклеары 2% будет сигналом о возможном заболевании. Небольшой рост вироцитов также наблюдается при новообразованиях, аутоиммунных процессах и после вакцинации у детей. Вироциты обнаруживаются с первых дней попадания инфекции. На 8-12 сутки их численность начинает расти и достигает отметки 10%. Это свидетельствует о критической стадии развития патологии и характеризует ее течение как тяжелое. Такой уровень описываемых клеток удерживается на протяжении 2-3 недель. Повторно концентрация вироцитов уточняется при помощи общего анализа через неделю. Это выполняется для того, чтобы отследить динамику протекания заболевания и оценить адекватность назначенной терапии. При этом следует отметить, что показатель атипичных мононуклеаров может быть достаточно высоким даже на протяжении полутора месяцев. Почему увеличиваются мононуклеарыФакторов или заболеваний, приводящих к росту численности вироцитов достаточно много, и все они связаны с попаданием в организм вирусной или бактериальной инфекции. Сюда входят следующие причины:
Следует отметить, что самый высокий уровень вироцитов выявляется при инфекционном мононуклеозе. Это заболевание развивается в результате попадания вируса Эпштейна-Барр, поэтому имеет второе название ВЭБ-инфекция. Практически всегда патология сопровождается повышением атипичных мононуклеаров свыше 10%, что является основным диагностическим признаком, подтверждающим данную болезнь. Источником заражения является инфицированный больной или здоровый человек (носитель), в организме которого находится вирус, но благодаря хорошему иммунитету заболевание не развивается. Чаще всего патология передается через больных, которые из-за невыраженной симптоматической картины не обращаются за помощью в больницу, вследствие чего заболевание не определяется. Путем передачи может быть контактный, бытовой (через предметы общего пользования) и воздушно-капельный. Инкубационный период у инфекционного мононуклеоза достаточно длительный, и с момента заражения до возникновения первых признаков может пройти около 2 месяцев.  Основные проявления инфекционного мононуклеоза Обширная медицинская практика показывает, что малыши до года достаточно редко болеют инфекционным мононуклеозом, что объясняется врожденным пассивным иммунитетом, передавшимся от матери. Кроме этого, установлено, что чаще всего наблюдается данная болезнь у детей старшего возраста – 7-10 лет и, как правило, у мальчиков. Продолжительность острой фазы заболевания составляет 15-20 дней. В процессе развития инфекция затрагивает носоглоточные миндалины, лимфоузлы, селезенку и нередко печень. Но в первую очередь страдает иммунная система, так как изначально ей приходится противостоять серьезному возбудителю. Затем на фоне сниженного иммунитета в большинстве случаев начинает присоединяться различная инфекция, сопровождающаяся такими осложнениями, как отиты, пневмонии, ангины и т.д. В отдельных случаях лейкоциты ребенка или взрослого при ВЭБ-инфекции более чем на 50% состоят из вироцитов. Основную роль в диагностике этого и других инфекционных заболеваний играют результаты лабораторных анализов. С их помощью удается относительно быстро и точно установить диагноз, разработать терапевтическую тактику и проводить регулярный контроль качества лечения. После выздоровления пациенту необходимо не меньше года наблюдаться у гематолога и проверять показатели мононуклеаров. Профилактические мероприятияЕдинственное, что может сделать человек, чтобы уберечься от заражения болезнетворными вирусами, – это регулярно проводить профилактические мероприятия. Очень важно позаботиться о нормальном функционировании иммунной системы, что позволит предупредить развитие болезни, если возбудителю удастся проникнуть в организм. Для этого следует выработать привычку сбалансированно и вовремя питаться, заниматься спортом, закаливанием, что значит вести активный образ жизни. Дополнительно рекомендуется принимать различные витаминные комплексы, которые помогут поддерживать организм в нормальном состоянии. Также необходимо при самых первых признаках вирусной инфекции обращаться за медицинской помощью, обследоваться и проводить назначенную терапию. Это позволит избежать развития серьезных осложнений и сохранить здоровье до глубокой старости. норма и причины повышения уровняС появлением ребенка родители приобретают новые знания, касающиеся не только воспитания, но и здоровья. Многие современные мамы более детально изучают анализы крови и их нормальные показатели. Главные из них – эритроциты, лейкоциты и тромбоциты. Кроме этого существуют различные виды лейкоцитов, чей процентный уровень в кровотоке входит в состав лейкоцитарной формулы. Обнаружение мононуклеаров у крохи родители часто связывают с болезнью. Всегда ли это так, или их присутствие может быть нормальным явлением? Мононуклеары – что это?Мононуклеарами называются одноядерные кровяные клетки. К ним относятся моноциты и лимфоциты. Еще одно название таких клеток – агранулоциты. Оно получено ими в результате того, что внутри у мононуклеаров нет гранул. Лимфоциты непосредственно несут ответственность за иммунные реакции, протекающие в организме. То, к какому типу относятся данные клетки, влияет на их деятельность. Одни из них отвечают за уничтожение вредоносных веществ или возбудителей инфекции, другие – за выработку антител. Не последнюю роль в работе иммунитета играют моноциты, которые еще известны как мононуклеарные фагоциты. Они преобразуются в макрофаги, таким образом поглощая бактерии и вирусы и сигнализируя лимфоцитам о том, что в организме крохи появились возбудители инфекции или другие нежелательные вещества. Обнаружение одноядерных клеток в кровиПрисутствие в кровотоке клеток, у которых в структуре всего одно ядро, видно по общему анализу крови. Происходит это при расшифровке лейкоцитарной формулы. В ней указываются все лейкоциты, в которые также входят моноциты и лимфоциты, с их процентным содержанием в крови. Контроль уровня мононуклеаров учитывается в следующих случаях:
Для того чтобы избежать неверных данных, необходимо соблюдать все правила корректного забора крови для общего анализа, а именно:
Расшифровкой анализа должен заниматься исключительно специалист. Сделав совокупную оценку всех показателей, он сможет дать характеристику общей картине. Установление самостоятельного диагноза на основании только одного параметра является неправомерным. Нормальные показатели мононуклеаровНиже в таблице представлены возрастные нормы моноцитов в лейкограмме для детей: (подробнее в статье: какой должна быть норма моноцитов в крови у детей?)
По отношению к лимфоцитам картина их процентного содержания в крови выглядит иначе. В течение первых дней жизни у новорожденных число лимфоцитов составляет 16-32% от всех лейкоцитов, на пятый день после рождения эти цифры вырастают до 40-60% и остаются такими на протяжении первых лет жизни. Уровень лимфоцитов у детей до 5 лет является самым высоким по сравнению со всеми другими лейкоцитами и составляет 35-55% (рекомендуем прочитать: норма лимфоцитов у детей: таблица во возрасту). Со временем их процентное содержание падает и к 10-летнему возрасту составляет 30-45% от всех белых кровяных телец. Атипичные мононуклеарыНеизмененные мононуклеары наблюдаются в крови деток даже когда они здоровы. В случае некоторых заболеваний в ней появляются измененные клетки, среди которых встречаются атипичные мононуклеары. По-другому эти измененные кровяные клетки называют вироцитами. В соответствии с их строением и функциями они относятся к числу белых кровяных клеток, обладают определенными схожими свойствами с обычными одноядерными клетками, а именно с моноцитами и лимфоцитами. Отличительная черта ядер атипичных мононуклеаров – полиморфизм и губчатая структура, а сами они по форме бывают круглыми или овальными. Размеры и состав цитоплазмы влияют на деление их на моноцитоподобные и лимфоцитоподобные. Многие ученые считают, что происхождение данных клеток берет свое начало от Т-лимфоцитов. Их выработка происходит вследствие различных факторов, одним из которых является проникновение в организм вирусов. Определить наличие в детском кровотоке атипичных мононуклеаров помогает клинический анализ крови, в который входит лейкограмма. В исследуемом объеме крови проводится подсчет данных клеток и их сравнение с количеством всех лейкоцитов. После их содержание приводят в процентном соотношении. Чаще всего при нормальных показателях атипичные мононуклеары в крови не выявляются, однако наличие одиночных вироцитов не относят к патологии, в результате чего их содержание в количестве 0-1% от всех белых кровяных клеток считают нормальными показателями для детей. Причины повышенного уровня мононуклеаровСамой распространенной причиной повышенного уровня атипичных мононуклеаров являются вирусные заболевания – к примеру, ветрянка. Однако существует ряд и других причин, из-за которых процентное содержание вироцитов растет. Это происходит по причине:
Обычно уровень таких клеток в лейкоцитарной формуле при анализе крови не переходит за 10% от всех лейкоцитов. В противном случае превышение этой цифры служит основанием для установления такого диагноза как инфекционный мононуклеоз. Другое название заболевания – ВЭБ-инфекция, так как его вызывает вирус Эпштейн-Барр. Такая болезнь характерна для детей после 1 года, при ней уровень атипичных мононуклеаров всегда повышается, иногда до 50% и даже выше. Ее инкубационный период может достигать 2 месяцев. Существует два варианта заражения мононуклеозом:
За счет поражения болезнью лимфоидной ткани, для болеющих ребят характерны воспаленные миндалины, лимфоузлы, печень и селезенка. К первым симптомам мононуклеоза относятся:
Сами вироциты появляются в крови только через 2-3 недели после заражения. Кроме того они продолжают циркулировать в кровотоке еще 5-6 недель, после того как кроха станет здоровым. Что предпринять при высоком уровне мононуклеаров в крови?В случае, когда в анализе крови крохи высокий уровень содержания атипичных мононуклеаров, необходимо обратиться к педиатру. Он проведет оценку общего состояния крохи, при этом учитывая недавние болезни. Это необходимо, так как перенесенная вирусная инфекция сказывается на уровне вироцитов в крови. После нее он может оставаться повышенным в течение еще нескольких недель. Если у малыша подтвердится диагноз ВЭБ-инфекция, его лечение сводится к борьбе с имеющимися симптомами. Оно включает средства, которые понижают жар, выступают в качестве антисептиков и оказывают общеукрепляющее действие. Какой-либо специфической терапии, помогающей преодолеть вирус Эпштейна-Барр, на сегодня нет. Обычно для этой болезни характерна легкая форма и дети полностью выздоравливают. За редким исключением этот вирус становится причиной:
Если была поражена печень, ребенку требуется определенное диетическое питание, дополненная лекарственными препаратами, которые имеют гепатопротекторный и желчегонный эффект. При наличии бактериальной инфекции применяют также антибиотики и пробиотики. Если болезнь протекает тяжело или ее сопровождают серьезные осложнения, вероятно назначение гормональных средств, проведение трахеостомии или искусственной вентиляции легких, удаление селезенки. Врач-педиатр 2 категории, аллерголог-иммунолог, окончила БГМУ Федерального агентства по здравоохранению и социальному развитию. Подробнее »Поделитесь с друьями! Атипичные мононуклеарные клетки: причины и морфологияАтипичные мононуклеарные клетки у детейВироциты могут встречаться в крови пациентов любого возраста. Атипичные мононуклеары у детей указывают на вирусное заболевание - мононуклеоз. Заболевание возникает из-за вируса Эпштейна-Барра, поражающего паренхиматозные органы и клетки лимфоидной ткани. Инфекционный процесс локализуется в глотке, печени и селезенке. Атипичные клетки появляются при ветряной оспе, поскольку вирус принадлежит к тому же роду, что и возбудитель мононуклеоза.Его действие снижает защитные свойства иммунной системы, открывая путь другим патологиям. Чаще всего атипичные мононуклеарные клетки обнаруживаются у детей 8-10 лет. Это связано с тем, что эта возрастная категория подвержена многим инфекционным заболеваниям. Меньше всего страдают дети до 1 года, в этом возрасте они обнаруживают около 0,5% всех случаев мононуклеарных клеток. Инфекция передается воздушно-капельным путем, при контакте между детьми, но нестабильна для окружающей среды. Симптомы атипичных мононуклеаров у детей:
В редких случаях на теле ребенка появляются высыпания петихиального характера (без определенной локализации) и желтушное окрашивание кожных покровов. Согласно медицинской статистике, чаще всего вирус обнаруживают у мальчиков, пик заболеваемости приходится на осенне-зимний и весенний период.Вредоносные микроорганизмы попадают на слизистую оболочку верхних дыхательных путей и распространяются по организму, поражая лимфатические узлы, печень и селезенку. Инкубационный период длится от 5 до 15 дней. Для восстановления нормального уровня вироцитов в крови проводится симптоматическая и общеукрепляющая терапия, которые направлены на устранение признаков инфекции. Антибиотики не используются, так как они не влияют на вирус. Лечебные свойства имеют витамины группы B, C, P. .[12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23] Морфология атипичных мононуклеарных клетокСтроение вирусных клеток во многом определяет механизм их действия и повреждения организма.Морфология атипичных мононуклеарных клеток указывает на то, что их возбудителем является вирус Эпштейна-Барра. Эти клетки относятся к вирусам герпеса, имеют сложную структуру и содержат ДНК в виде двойной спирали. Вирус устойчив к низким температурам и высыханию. Инфекция передается воздушно-капельным, контактным и гемоконтактным путями. Заболевание протекает в виде спорадических вспышек. Как правило, инфекция диагностируется у детей дошкольного и школьного возраста, преимущественно у мальчиков. Дети до года не болеют из-за пассивного иммунитета.Заболевание - явление сезонное, обострение наблюдается в зимне-весенний период. Заболевание не рецидивирует, летальность низкая, но есть данные об единичных случаях разрыва селезенки, поражения ЦНС и стеноза гортани.
Проникновение вируса осуществляется через слизистую оболочку верхних дыхательных путей и ротоглотки. Адгезия происходит за счет использования рецепторов, которые расположены на поверхности клеток эпителия. Распространение вируса приводит к разрушению клеток, что вызывает выброс новых поколений инфекции в кровоток.Атипичные мононуклеары инфицированы В-лимфоцитами с измененными функциональными и морфологическими свойствами. Патологические изменения в иммунной системе приводят к тому, что организм не в состоянии полностью нейтрализовать вирус, который может оставаться латентным при жизни для В-лимфоцитов на всю жизнь. Клетки морфологически сходны с атипичными мононуклеарными клеткамиТак как вироциты указывают на наличие инфекции в организме, существуют и другие клеточные структуры с ними похожие. Лимфоциты - это клетки, морфологически похожие на атипичные мононуклеары.По форме и размеру они похожи на ядро, цитоплазму. Они обнаруживаются в крови при различных вирусных заболеваниях (краснуха, грипп, корь, ветряная оспа), аутоиммунных заболеваниях, аллергических реакциях, вакцинации и различных опухолях. Исходя из этого различают два типа атипичных мононуклеарных клеток: моноцитоподобные и лимфоцитоподобные. Лимфоцитоподобные отличаются от лимфоцитов тем, что имеют пенистую цитоплазму, для них характерен полиморфизм ядра от губчатой структуры.То есть вироциты - это мутировавшие Т-лимфоциты. В редких случаях выявляются клетки с гранулярной α-нафтилацетат-цестазой, не ингибируемой NaF. Вироциты обладают высокой активностью кислой фосфатазы, лактата, α-глицерофосфата и сукцината дегидрогеназы. [24], [25], [26], [27], [28], [29] Анализ крови на атипичные мононуклеарыДиагностика вирусных и инфекционных заболеваний предполагает проведение различных исследований. Анализ крови на атипичные мононуклеары проводят при клинических симптомах мононуклеоза и подобных заболеваний.Вироциты определяются с помощью общего анализа крови, который оценивает качественный и количественный клеточный состав, формулу лейкоцитов, соотношение объема плазмы и клеток, показатели цвета и СОЭ. Модифицированные Т-лимфоциты выявляются с помощью формулы лимфоцитов (процентное соотношение различных типов лейкоцитов). Его используют для диагностики инфекционных, воспалительных и гематологических недугов, а также для оценки эффективности лечения. Мононуклеоз подтверждается в том случае, если в крови присутствует более 10% атипичных клеточных структур. [30], [31], [32], [33], [34] Атипичные мононуклеары при мононуклеозеПрисутствие вирусоцитов в крови указывает на инфекционное заболевание, вызванное вирусом Эпштейна-Барра. Атипичные мононуклеарные клетки при мононуклеозе, как правило, превышают порог в 10%. Инкубационный период точно не установлен, он колеблется от 5 до 21 дня, а в отдельных случаях до 1-2 месяцев. Заболевание начинается с резкого повышения температуры, воспаления шейных лимфатических узлов, затруднения носового дыхания.Позже пациенты могут пальпировать увеличенные селезенку и печень. Если мононуклеоз имеет атипичную форму, то клиническая симптоматика размазывается, поэтому болезнь можно распознать только с помощью лабораторных исследований. Затяжные и хронические формы характеризуются гематологическими изменениями и лимфаденопатией, которые могут сохраняться в течение 4-6 месяцев. Критерием степени тяжести является выраженность синдрома интоксикации, длительность заболевания и наличие осложнений. Атипичные мононуклеарные клетки в крови требуют специального лечения.Для терапии используются глюкокортикостероиды и витаминные комплексы. Антибиотики не используются, потому что они не действуют на вирус. Если в патологический процесс вовлечена печень, пациенту назначают диетический стол №5а / №5. При отсутствии должного лечения заболевание имеет неблагоприятный прогноз и грозит осложнениями. Чаще всего это неврологические нарушения, протекающие при асептическом менингите, энцефалите и других патологиях. [35], [36], [37], [38], [39], [40], [41] .атипичных мононуклеарных клеток | Ответы врачейСамые популярные ответы врачей, основанные на вашем поиске: 29-летняя женщина спросила: Опыт 30 лет Медицинская онкология Требуется дополнительное тестирование: я предполагаю, что это периферическая кровь, вам нужно больше работать вверх попросите направить к гематологу 29-летняя женщина спросила: 39 лет опыта Аллергия и иммунология Трудно дать: требуется точный диагноз с отрывочным лабораторным результатом, клинической корреляцией и дополнительной информацией, спросите врача, который заказал тест 48-летний участник спросил: 32 года опыта Диагностическая радиология То есть: хороший вопрос, но, возможно, не подходит для этого форума. 55-летняя женщина спросила: 43-летний опыт Патология Не опухоль: это место старого кровотечения и, вероятно, инфекции или физической травмы. Дело в том, что опухоли не обнаружено. Любая интерпретация, выходящая за ... Подробнее35-летняя женщина спросила: 56-летний опыт работы в семейной медицине ToBeInterpretedByMD: Что-то не так с результатами, описанными вами. Есть только 11 лейкоцитов и лимфоцитов и мононуклеарные клетки также являются лейкоцитами.Результаты LP ar ... Подробнее.Frontiers | Жестокое обращение с детьми связано со снижением уровня рецептора окситоцина в мононуклеарных клетках периферической кровиВведениеСтрессовый жизненный опыт тесно связан с более высоким риском развития психических заболеваний (Agid et al., 2000). Все больше литературы посвящено влиянию негативного опыта ранней жизни, называемому жестоким обращением с детьми, на физическое (Heim and Nemeroff, 2001) и психическое здоровье (Edwards et al., 2003). Переживание CM было связано с повышенным риском развития расстройств травматического спектра, таких как посттравматическое стрессовое расстройство и депрессия (Felitti Md et al., 1998), в то время как развитие тревожных расстройств было более тесно связано с ранними семейными факторами, такими как потеря родителей в детстве. (Heim, Nemeroff, 2001; Kendler et al., 2009). Окситоцин (OXT), нейропептид, состоящий из девяти аминокислот, в основном продуцируется в паравентрикулярном и супраоптическом ядрах гипоталамуса (Insel, 1992).Окситоцинергические нейроны проникают в области мозга, участвующие в социальном и материнском поведении (Gimpl and Fahrenholz, 2001; Strathearn, 2011). OXT обладает анксиолитическим действием и связан со снижением стрессового поведения (Gimpl and Fahrenholz, 2001; Neumann and Landgraf, 2012). Кроме того, периферические эффекты OXT связаны с эндокринными и иммунными функциями, такими как противовоспалительные эффекты (Gimpl and Fahrenholz, 2001; Pont et al., 2012). Несколько исследований на животных изучали роль прикрепления к различным центральным и периферическим пептидам.В частности, нейротрофический фактор мозга (BDNF) был обнаружен как важный модулятор в отношении поведения социальной привязанности (Marazitti et al., 2008; Branchi et al., 2013). За последние 20 лет количество соответствующих исследований поведения привязанности на людях резко увеличилось. Паттерны привязанности у взрослых и их младенцев сильно связаны с эмоциональной регуляцией (Bowlby, 1969; Ainsworth et al., 1978). Для оценки репрезентации привязанности взрослых в основном используются самоотчеты (Rochman et al., 2008; Kiss et al., 2011), и лишь несколько исследований работают с повествовательными интервью для оценки привязанности, например, собеседование с взрослыми (AAI) или система проективных изображений привязанности взрослых (AAP) (Buchheim et al., 2009). Однако несколько клинических исследований подтверждают возможность использования AAP в качестве стимула в нейробиологической науке, связанной с привязанностью (Buchheim et al., 2006, 2008). Установлено, что межличностная привязанность, неблагоприятный жизненный опыт и воспринимаемый стресс связаны с уровнем OXT в крови (Emeny et al., 2015). Было показано, что уровни OXT в плазме связаны с различными представлениями привязанности у людей (Bakermans-Kranenburg and van Ijzendoorn, 2013). В исследовании Pierrehumbert и коллег (2012) изучали OXT в плазме до и после процедуры лабораторного стресса ( Trier Social Stress Test , TSST) и обнаружили более высокие уровни OXT после стрессора TSST только у надежно прикрепленных лиц (Pierrehumbert et al., 2012 ). Olff et al. (2013) сообщили о более высоких уровнях OXT в плазме у взрослых, перенесших CM (Olff et al., 2013). Напротив, исследование Heim and Associates (2009) показало более низкие уровни OXT в спинномозговой жидкости женщин с хроническим CM (Heim et al., 2009). Таким образом, результаты OXT в центральной нервной, а также в периферических системах органов противоречивы (Valstad et al., 2016), а в отношении депрессии и тревоги исследования связи между центральным и периферическим уровнями OXT дали противоречивые данные ( Massey et al., 2016). Рецептор окситоцина (OXTR) представляет собой G-белок из семи трансмембранных доменов, расположенный в структуре цитоплазматической мембраны (Gimpl and Fahrenholz, 2001; Zingg and Laporte, 2003), и экспрессируется в головном мозге, периферических тканях, а также в лимфоцитах. (Gimpl and Fahrenholz, 2001; Yamaguchi et al., 2004). Экспрессия гена OXTR уже определена, например, в лимфоцитах периферической крови человека, а также в макрофагах с помощью количественной ПЦР в реальном времени (кПЦР) (Yamaguchi et al., 2004; Szeto et al., 2008). Было показано, что CM связан с измененной иммунной функцией в зрелом возрасте (Boeck et al., 2016), и исследования предоставили доказательства противовоспалительной роли OXT через связывание с его специфическим рецептором (Szeto et al., 2008). В нескольких исследованиях была обнаружена связь между опытом OXTR и CM с использованием методов определения метилирования гена OXTR , которое может привести к изменению экспрессии гена OXTR (Kumsta and Heinrichs, 2013; Smearman et al., 2016). Группа Smearman et al. (2016) сообщили о более высоком метилировании гена OXTR , связанном с опытом CM (Smearman et al., 2016). Кроме того, было обнаружено, что низкий уровень материнской заботы связан с более высоким метилированием OXTR (Unternaehrer et al., 2012). Эти находки указывают на важную роль OXTR в понимании влияния CM на биологические процессы. Однако результаты исследования экспрессии гена OXTR или метилирования гена OXTR нельзя напрямую сравнивать с уровнем белка OXTR на иммунных клетках. Таким образом, мы стремились осуществить количественную оценку экспрессии белка OXTR в мононуклеарных клетках периферической крови человека (PBMC). Фракция PBMC состоит из разных типов клеток: лимфоцитов (Т-клетки, В-клетки и NK-клетки), моноцитов и дендритных клеток. В человеческих PBMC лимфоциты находятся в диапазоне от 70 до 90%, моноциты от 10 до 20%, а дендритные клетки встречаются редко, с 1-2% (Kleiveland, 2015). У людей частота встречаемости этих популяций варьируется от человека к человеку. Недавно сообщалось об экспрессии OXTR с помощью вестерн-блоттинга для миометрия человека во время беременности (Grotegut et al., 2013) и в лимфоцитах крупного рогатого скота (Ndiaye et al., 2008). Применяя ту же технику, мы ожидали найти отрицательную связь между нагрузкой CM и экспрессией белка OXTR в PBMC, а также более низкими уровнями OXT в плазме периферической крови. Кроме того, мы ожидали, что эта негативная ассоциация будет более выражена у матерей с CM и небезопасными репрезентациями привязанности. Материалы и методыДизайн исследованияИсследование было одобрено этическим комитетом Ульмского университета и проводилось в соответствии с Хельсинкской декларацией.Письменное информированное согласие было получено от всех субъектов до их участия. Женщин набирали в родильном отделении университетской больницы Ульма в течение 1 недели после родов и приглашали к участию в двух последовательных временных точках (t 0 , t 1 ). Точка времени t 0 приходилась на срок до 6 дней после родов в родильном отделении университетской больницы Ульма и состояла из оценки основных социально-демографических, медицинских и связанных с детьми данных (CTQ) (Bader et al., 2009). В t 1 , через 3 месяца после родов, матери были приглашены на психодиагностическое интервью в рабочую группу по клинической и биологической психологии (Университет Ульма). После фазы отдыха ~ 15–20 минут представление привязанности оценивалось с помощью системы проективных изображений привязанности у взрослых (AAP) (George and West, 2012). Оба момента времени (t 0 и t 1 ) контролировались подготовленными психологами. Перед психологической оценкой образцы цельной крови были собраны путем венозной пункции в пробирки с буфером ЭДТА (Sarstedt, Nuermbrecht, Германия) для выделения PBMC на основе фиколла.Уровни OXT измеряли в аликвотах плазмы, полученных из другого забуференного ЭДТА образца цельной крови, непосредственно перед системой проективного изображения привязанности взрослых (AAP). УчастникиВ общей сложности с 1460 женщинами обратились для участия в исследовании в родильном отделении университетской больницы Ульма. Критериями исключения были возраст <18 лет, недостаточное знание немецкого языка, тяжелые осложнения во время родов или проблемы со здоровьем матери и / или ребенка, преждевременные роды, текущее потребление наркотиков, наличие в анамнезе психотических расстройств или текущих инфекций.Двести сорок матерей предоставили письменное информированное согласие и прошли скрининговое интервью (t 0 ). Шестьдесят семь матерей последовали приглашению и приняли участие в контрольном интервью через 3 месяца (t1). Восемнадцать субъектов были исключены: пять из-за недостаточного качества записи повествований AAP, один из-за неудачного анализа крови, один из-за острой инфекции и одиннадцать из-за ограниченной доступности биоматериала для вестерн-блоттинга. Кроме того, все матери, кормившие грудью до забора крови (за час до начала AAP), были исключены из биологических анализов.Одно значение OXT в плазме не могло быть оценено из-за неудачного анализа крови у одной женщины из группы CM-. Существенных групповых различий по возрасту и индексу массы тела (ИМТ) не обнаружено. Таким образом, окончательная когорта исследования составила n = 49 матерей. Психологические анкетыКак упоминалось ранее, немецкая версия опросника о детских травмах (CTQ; Bader et al., 2009) использовалась для оценки опыта эмоционального, физического или сексуального насилия, а также эмоционального и физического пренебрежения.CTQ охватывает эти пять подшкал с пятью пунктами каждая, которые оцениваются по пятибалльной шкале Лайкерта, при этом более высокие значения указывают на более высокую нагрузку опыта CM. Суммарный балл по всем 25 пунктам (от 25 до 125) был рассчитан как совокупный показатель жестокого обращения, то есть нагрузки от жестокого обращения (Schury and Kolassa, 2012). Критерии отсечения, установленные Бернштейном и Финком (1998), применялись для классификации тяжести переживаний КМ в каждой из субшкал как «нет», «низкая», «умеренная» или «тяжелая» (Bernstein and Fink, 1998). .Основываясь на этих классификациях, когорта исследования была разделена на две группы: те, кто сообщил об «умеренном» или «тяжелом» переживании CM хотя бы по одной подшкале CTQ, были отнесены к категории CM + ( n = 15), все остальные испытуемые были относится к категории CM− ( n = 34). Утвержденная немецкая версия Госпитальной шкалы тревожности и депрессии (HADS-D) была применена для количественной оценки симптомов тревоги и депрессии, которые объединены в две подшкалы из 7 пунктов, оцененных по четырехбалльной шкале Лайкерта, которые можно классифицировать. следующие: 0–7 отсутствие патологических данных, 8–10 суггестивное расстройство настроения,> 11 вероятное наличие тревожного / депрессивного расстройства (Herrmann-Lingen et al., 1995). Мера крепленияСистема проективных изображений привязанности (AAP) взрослых состоит из набора графических стимулов и обычно используется для оценки репрезентации привязанности у взрослых (George and West, 2012). Этот набор изображений включает восемь штриховых рисунков, состоящих из одного нейтрального изображения разминки и семи сцен вложения. Сцены привязанности показывают ситуации привязанности, когда люди остаются одни или в потенциальных парах привязанности. Во время AAP людей просят рассказать историю, связанную с ситуацией, изображенной в каждом отдельном стимуле.Интервью AAP было проведено обученными психологами (подготовленными соавтором: AB). Представленные истории были записаны на аудиозаписи и дословно. Кроме того, истории были задокументированы для классификации представлений о привязанности. «Связность» и «Самостоятельность» оцениваются в повествовательных ответах на «монадические» картинки, представляющие одного человека. Напротив, сцены диадических изображений оцениваются по степени их синхронности в описываемых взаимодействиях. Классификация безопасного присоединения (F) кодируется, когда люди демонстрируют высокий уровень связанности и синхронности.Неуверенно-отвергающие (Ds) или небезопасно-озабоченные (E) люди указывают на отсутствие или дисфункциональные отношения в оценке AAP. Наконец, людей с неразрешенной травмой (U) подавляют связанные с привязанностью травмы, такие как страх или угроза (George and West, 2012). Недавние исследования показали межэкспертную надежность для четырех групп привязанности 90%, κ = 0,84, p <0,001, а для безопасных и незащищенных групп даже 97%, κ = 0,89 и p <0,001 (Джордж и Запад, 2012). Уровни OXT плазмыОбразцы крови брали из антекубитальных вен в моноветки объемом 7,5 мл, содержащие ЭДТА (Sarstedt, Германия). Моноветки и пробирки с ЭДТА предварительно охлаждали на льду. Сразу после взятия крови моноветки с ЭДТА центрифугировали при 4 ° C и 1,300 g в течение 15 мин. Определенный объем 800 мкл полученной плазмы делят на аликвоты для определения OXT. После завершения партии все образцы плазмы были отправлены на сухом льду в лабораторию Р. Ландграфа (RIAgnosis, Sinzing).OXT плазмы измеряли в экстрагированных образцах плазмы и определяли с помощью утвержденного радиоиммуноанализа (РИА) с чувствительностью анализа в диапазоне 0,1 пг / образец (Kagerbauer et al., 2013). Измерение экспрессии белка OXTR в PBMC человекаЦентрифугирование в градиенте Ficoll-Hypaque выполняли для выделения PBMC в соответствии с протоколом производителя (GE Healthcare, Chalfon St Giles, UK). Иммунные клетки лизировали с использованием стандартных процедур (Masutomi et al., 2005), и полученный супернатант, содержащий белок, замораживали при -80 ° C и хранили для вестерн-блоттинга.Пятнадцать микрограммов общего белкового экстракта использовали для дальнейшей подготовки образцов. Белки разделяли с помощью SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) с последующим иммуноблоттингом разделенных белков на мембране. Для каждого блоттинга использовали внутренний эталонный образец в качестве внутреннего действительного контрольного образца. PVDF-мембрану инкубировали с первичными антителами [anti-OXTR, 1: 1000, Sigma Aldrich, Германия; анти-глицеральдегид-3-фосфатдегидрогеназа (GAPDH; контрольное антитело), 1: 5,000, Thermo Scientific, Германия] в течение ночи при 4 ° C.Затем блоты инкубировали со вторичными антителами (антикроличьи, 1: 1000, Dako, Glostrup, Дания; антимышиные, 1: 10 000, Invitrogen, Германия) в течение не менее 1 ч при комнатной температуре. Молекулярная масса белка OXTR составляет ~ 43 кДа, а надежный домашний белок глицеральдегид-3-фосфатдегидрогеназа (GAPDH) обнаруживается при 36 кДа. Полосы белка анализировали с помощью Bio-Rad Software Image Lab 5.0 (Bio-Rad Laboratories). Экспрессия белков OXTR и GAPDH была представлена относительно уровня экспрессии внутреннего эталонного образца для каждого блота, чтобы минимизировать различия между разными блотами.Значения экспрессии белка OXTR были нормализованы к загрузочному контролю GAPDH и представлены как% от внутреннего эталонного образца, обработанного на каждом блоте. СтатистикаОстаточные данные были проверены на нормальное распределение с помощью критерия Колмогорова – Смирнова. Из-за непараметрического распределения данных, групповые сравнения между CM- матерями и CM + матерями, а также между безопасными и незащищенными матерями в рамках всей когорты исследования были рассчитаны с использованием тестов Mann-Whitney- U . Кроме того, корреляции экспрессии белков OXT и OXTR в плазме с суммарным баллом CTQ, уровнями тревожности и депрессии были выполнены с использованием корреляционного анализа Спирмена-ро.Распределение матерей CM- по сравнению с CM + в пределах подшкалы CTQ было проверено с использованием критерия хи-квадрат (точный критерий Фишера). Статистические тесты проводились при α = 0,05. Анализ данных проводился с помощью IBM SPSS Version 23. РезультатыОписательные и клинические характеристикиКлинические и психометрические характеристики участников представлены в таблице 1. Тридцать четыре матери были классифицированы как CM−. Пятнадцать матерей сообщили о умеренной истории CM по крайней мере по одной подшкале (эмоциональное насилие, физическое насилие, сексуальное насилие, эмоциональное пренебрежение и физическое пренебрежение) CTQ и поэтому были классифицированы как CM +. Таблица 1 . Описательные и клинические характеристики. Экспрессия белка OXTR в PBMC человекаНа первом этапе мы использовали коммерчески доступные антитела (OXTR, Sigma Aldrich, Steinheim, Германия) и протестировали серию из восьми различных концентраций экстрактов белка PBMC по сравнению с внутренним эталонным контролем. Количество белка варьировалось от 2,5 до 20 мкг с шагом 2,5 мкг. Образец, свободный от белка, использовали в качестве отрицательного контроля. PageRuler Plus Prestained Protein Ladder (Thermo Scientific, Дармштадт, Германия) использовался в качестве справочной лестницы веса.Серия белков OXTR с соответствующим контролем загрузки GAPDH (глицеральдегид-3-фосфатдегидрогеназа) демонстрирует линейность обнаруживаемости антител, показанную на рисунке 1. Рисунок 1 . Экспрессия OXTR (43 кДа) и соответствующий контроль нагрузки GAPDH (36 кДа) были измерены, чтобы показать линейность обнаруживаемости антител OXTR в человеческих PBMC. Установление антитела проводили с серией разведений количества белка от 2.От 5 до 20 мкг с шагом 2,5 мкг в пределах внутреннего эталонного контроля. Образец без белка (0 мкг) использовали в качестве отрицательного контроля; OXTR, рецептор окситоцина; GAPDH, глицеральдегид-3-фосфатдегидрогеназа ; кДа, килодальтон. Уровни OXT в плазме и экспрессия белка OXTR в связи с историей CMУровни OXT в плазме существенно не различались между двумя группами CM ( z = -0,49, p = 0,625) (рис. 2). Кроме того, уровни OXT в плазме не имели значимой корреляции ни с суммарным показателем CTQ [ r (49) = 0.07 , p = 0,625], ни с экспрессией белка OXTR [ r (49) = -0,18, p = 0,229]. Рисунок 2 . Уровни OXT в плазме измеряли с помощью радиоиммуноанализа в образцах плазмы матерей CM− по сравнению с матерями CM + ( n = 48). Групповых различий в OXT не обнаружено (тест Mann-Whitney- U , z = -0,49, p = 0,625). CM +, женщины, перенесшие жестокое обращение с детьми как минимум средней или тяжелой степени; CM−, женщины, ранее не подвергавшиеся жестокому обращению с детьми. Напротив, экспрессия белка OXTR была значительно снижена у CM + по сравнению с CM- женщинами ( z = -2,66, p = 0,008) (Рисунок 3). Репрезентативный блот экспрессии белка OXTR и соответствующий контроль нагрузки GAPDH , измеренный в человеческих РВМС, показан на Фигуре 4. Рисунок 3 . Уровни экспрессии белка OXTR, измеренные с помощью вестерн-блоттинга ( n = 49, средние значения для группы: CM- матери = 99%, SEM = 8%; CM + = 66%, SEM = 6%).Экспрессия белка OXTR была ниже в PBMC матерей CM + по сравнению с матерями CM− ( тест Mann-Whitney-U , z = −2,66, p = 0,008). Значения экспрессии белка OXTR были нормализованы к загрузочному контролю GAPDH и представлены как% от внутреннего эталонного образца, обработанного на каждом блоте. CM +, женщины, перенесшие жестокое обращение с детьми как минимум средней или тяжелой степени; CM−, женщины, ранее не подвергавшиеся жестокому обращению с детьми; SEM, стандартная ошибка среднего. Рисунок 4 .Репрезентативный блот экспрессии белка OXTR (43 кДа) и соответствующий контроль нагрузки GAPDH (36 кДа), измеренный в PBMC человека. OXTR, рецептор окситоцина; GAPDH, глицеральдегид-3-фосфатдегидрогеназа; кДа, килодальтон; CM−, женщины, ранее не подвергавшиеся жестокому обращению с детьми; CM +, женщины, перенесшие жестокое обращение с детьми как минимум средней или тяжелой степени; C, внутренний эталонный образец, работающий на каждом блоте. Кроме того, нагрузка жестокого обращения и экспрессия белка OXTR в PBMC значимо коррелировали.Мы обнаружили отрицательную связь между суммой CTQ и уровнями экспрессии белка OXTR [Корреляция Спирмена-Ро, r (49) = -0,36, p = 0,010, рис. 5]. Рисунок 5 . Корреляция сумм CTQ и экспрессии белка OXTR в человеческих PBMC. Матери с более высоким суммарным баллом CTQ показали более низкий уровень экспрессии белка OXTR в PBMC [Корреляция Спирмена-Ро, r (49) = -0,36, p = 0.010]. OXTR, рецептор окситоцина; CTQ, Опросник детской травмы. Экспрессия белков OXT и OXTR в плазме в связи с симптомами депрессии и тревогиЛица с CM показали значительно более высокий уровень тревожности по сравнению с CM- матерями ( z = -3,10, p = 0,002). Кроме того, зарегистрированные уровни тревожности были значительно выше с увеличением суммы баллов CTQ [ r (49) = 0,33, p = 0,019]. Однако тяжесть депрессивных симптомов существенно не различалась между группами CM + и CM- ( z = -1.07, p = 0,287), а суммарный балл CTQ не коррелировал с суммарным баллом депрессии HADS [ r (49) = 0,14, p = 0,338]. Точно так же нет значимой корреляции между уровнями OXT и суммой баллов депрессии HADS [ r (48) = -0,028, p = 0,849] или суммой баллов тревожности HADS [ r (48) = 0,03, p = 0,829]. Наконец, экспрессия OXTR в PBMC не коррелировала с уровнем тревожности матери [ r (49) = -0.07, p = 0,641], ни с уровнями депрессии [ r (49) = -0,12, p = 0,415]. Экспрессия белков OXT и OXTR в плазме и представления прикрепленияНа основании AAP 10 матерей были классифицированы как безопасные (F), а 34 женщины - как (D, E и U). Безопасные по сравнению с незащищенными матерями не различались по сумме баллов тревожности HADS ( z = 0,00, p = 1,000), сумме баллов депрессии HADS ( z = -0,03, p = 0.977), или в сумме CTQ ( z = -1,15, p = 0,250). Кроме того, уровни OXT в плазме существенно не различались между безопасными и небезопасными матерями ( z = -1,55, p = 0,121), и не было значительных различий между обеими группами привязанности в отношении экспрессии белка OXTR ( z = −1,38, p = 0,166). Интересно, что классификации прикрепления AAP показали, однако, значительную корреляцию с экспрессией белка OXTR в PBMC человека в зависимости от суммарных баллов CTQ: у матерей с небезопасным представлением прикрепления более низкая экспрессия белка OXTR была связана с более высокими суммарными баллами CTQ [ r (34) = −0.35, p = 0,040], тогда как у матерей с безопасным представлением прикрепления не было обнаружено никакой связи между экспрессией белка OXTR и суммой баллов CTQ [ r (10) = -0,48, p = 0,160; Рисунок 6]. Рисунок 6 . Корреляция общей суммы CTQ с экспрессией белка OXTR в PBMC человека незащищенных матерей (Ds, E и U). У незащищенных матерей выявлена более низкая экспрессия белка OXTR, связанная с более высокими суммарными баллами CTQ [Корреляция Спирмена-Ро, r (34) = -0.35, p = 0,040]. OXTR, рецептор окситоцина; CTQ, Опросник детской травмы. ОбсуждениеЭкспрессия белкаOXTR была значительно ниже у CM + по сравнению с матерями CM-, а нагрузка от жестокого обращения отрицательно коррелировала с экспрессией белка OXTR в PBMC. Кроме того, более низкая экспрессия белка OXTR была особенно выражена у женщин с незащищенными представлениями привязанности. Кроме того, не было обнаружено никаких ассоциаций между уровнями OXT, переживаниями CM, оценками депрессии или представлением о привязанности, что свидетельствует об изменениях на уровне OXTR, но не на уровне периферических OXT как долгосрочных последствиях воздействия CM.В соответствии с предыдущими результатами, это исследование обнаружило положительную корреляцию между оценками тревожности и нагрузкой CM (Simon et al., 2009), но не обнаружило связи между экспрессией белков OXT или OXTR в плазме и оценками тревожности или депрессии соответственно. Периферийные уровни OXT в зависимости от истории CMЭто исследование не обнаружило значительного изменения периферических уровней OXT в зависимости от нагрузки жестокого обращения, что согласуется с исследованием Chatzittofis et al. (2014). Напротив, в нескольких предыдущих исследованиях сообщалось о более низких или более высоких уровнях периферического ОКТ в связи с опытом КМ (Opacka-Juffry and Mohiyeddini, 2012; Olff et al., 2013; Зельцер и др., 2014). Причины несогласованности результатов исследования могут заключаться в 1) неоднородности методологического спектра определения OXT и 2) коротком периоде полужизни периферического пептида (1-2 мин) (Gimpl and Fahrenholz, 2001; Massey et al. , 2016). Наши измеренные уровни OXT в плазме распространились в физиологическом диапазоне, что свидетельствует в пользу надежной процедуры анализа RIA, и были сопоставимы с периферически измеренными значениями OXT в плазме в литературе (Marazziti et al., 2006). Используемый анализ RIA определил уровни OXT в экстрагированных образцах плазмы, что отражает хорошо проверенный метод измерения (Szeto et al., 2011; McCullough et al., 2013). В этом исследовании уровни OXT в плазме оценивались на исходном уровне без специфического стимула, который может активировать систему OXT. Предыдущие исследования показали, что у людей, подвергшихся жестокому обращению, наблюдается более высокое высвобождение OXT в ответ на психологический стрессор (Seltzer et al., 2014). Напротив, наши собственные исследования также не показали изменений OXT в плазме, влияющих на CM, но значительное увеличение периферических уровней OXT в ответ на стрессор привязанности (AAP) (Krause et al., 2016). Следовательно, уровень OXT в плазме участников, подвергшихся жестокому обращению, может чрезмерно реагировать на острый стрессор, в то время как он остается неизменным в отношении уровней OXT в состоянии покоя. Подавление белка OXTR в связи с историей CMНасколько нам известно, это исследование является первым, в котором была определена экспрессия белка OXTR в PBMC человека с помощью вестерн-блоттинга. Обнаружение экспрессии гена OXTR с помощью кПЦР уже было выполнено в лимфоцитах крови человека (Yamaguchi et al., 2004). Регуляция экспрессии белка OXTR сложна (Gimpl and Fahrenholz, 2001), и до сих пор не было обнаружено прямой связи между уровнями экспрессии гена OXTR и белком OXTR.Групповые сравнения в нашем исследовании выявили более низкую экспрессию белка OXTR у женщин с CM. Кроме того, мы обнаружили отрицательную связь между экспрессией белка OXTR и нагрузкой жестокого обращения. Эти результаты подтверждают чувствительность и изменчивость системы OXTR в иммунных клетках и предполагают долгосрочные изменения, особенно влияющие на OXTR в иммунных клетках. Эти изменения могут иметь дозозависимый и хронический характер, поскольку они могут быть обнаружены через несколько лет или десятилетий после воздействия КМ.Исследования на животных показали возрастную связь стресса в молодом возрасте и связывания OXTR в мозге взрослых самцов крыс. Связывание OXTR было значительно ниже в боковой перегородке и хвостатой скорлупе после отделения матери в детстве (Lukas et al., 2010). Поддерживая наши результаты, Smearman et al. (2016) обнаружили более высокое метилирование гена OXTR в лейкоцитах детей, подвергшихся насилию (Smearman et al., 2016). Эти эпигенетические модификации, т.е. повышенное метилирование ДНК, могут приводить к подавлению экспрессии белка OXTR в зависимости от нагрузки жестокого обращения.Таким образом, невзгоды в раннем возрасте могут наложить важные долгосрочные эффекты на сигнальные каскады системы OXT / OXTR. В частности, подавление OXTR может привести к более высокой восприимчивости, например, к воспалительным процессам или усиленной уязвимости к заболеваниям у матерей с CM. Иммунологическая роль подавления OXTRОпытCM связан с изменением иммунной функции в зрелом возрасте (Boeck et al., 2016). Рассматривая клеточные субпопуляции PBMC и их связанные со стрессом изменения, исследования предоставляют доказательства адаптивного изменения в составе субпопуляций иммунных клеток после воздействия травматического стресса (Sommershof et al., 2009; Morath et al., 2014). Используя сортировку клеток с активацией флуоресценции (FACS), Boeck et al. (2017) не обнаружили существенных различий между CM + и CM- матерями в отношении процентного содержания выбранных субпопуляций лейкоцитов CD3 + T-клеток, CD3 + CD8 + цитотоксических T-клеток, CD14 + моноцитов, CD3- CD14- B и NK-клеток). Эти находки укрепляют точку зрения, что наши находки изменений в экспрессии OXTR не связаны с изменениями состава в PBMC (Boeck et al., 2017). Индивидуальные функции OXTR в различных субячейках PBMC все еще неизвестны.Будущие исследования должны рассмотреть адаптивную природу состава PBMC в контексте CM и последствия для передачи сигналов OXT, чтобы лучше понять точную природу наших находок. В последнее время накоплены доказательства того, что люди с CM демонстрируют повышенную воспалительную сигнализацию, что отражается в повышенных уровнях провоспалительных цитокинов, таких как интерлейкин 6 (IL-6) и фактор некроза опухоли (TNF) (Carpenter et al., 2010; Lopes et al. др., 2012). Исследования предоставили доказательства противовоспалительной роли OXT, поскольку он опосредует противовоспалительное действие посредством связывания со своим специфическим рецептором, тем самым ослабляя высвобождение провоспалительных цитокинов (Szeto et al., 2008). Соответственно, активация OXTR стимулирует, например, экспрессию нескольких цитокинов (гены IL-2 и IL-4), участвующих в противовоспалительных иммунных ответах, и ослабляет секрецию провоспалительных цитокинов (Pont et al., 2012; Oliveira-Pelegrin et al. al., 2013; Wang et al., 2015). В связи с этим физиологические иммунные процессы, такие как высвобождение противовоспалительных цитокинов, могут быть нарушены после воздействия CM, вызванного более низкой экспрессией OXTR, обнаруживаемой у людей с опытом CM. Этот факт может объяснить провоспалительный фенотип во взрослом возрасте, связанный с переживаниями CM.Наконец, это исследование выдвигает на первый план важный вопрос дальнейших исследований, касающихся адаптивной иммуномодуляции и системы OXTR в сочетании с опытом ранних невзгод. Одним из возможных шагов могло бы быть исследование экспрессии белка OXTR в различных подмножествах PBMC. Уровни экспрессии белков OXT и OXTR в плазме и представление прикрепленияВ литературе ген OXTR рассматривался как один из возможных источников вариаций в представлении младенческой привязанности, что свидетельствует о связи OXTR rs2254298 с безопасностью привязанности младенца (Chen et al., 2011). В нашем исследовании экспрессия белка OXTR была отрицательно связана с нагрузкой жестокого обращения, особенно у матерей с незащищенными представлениями о привязанности. Однако мы не обнаружили связи между представлением прикрепления и уровнями OXT в периферической плазме. В нашу когорту исследования вошли 10 надежных матерей по сравнению с 34 незащищенными матерями, поэтому распределение по группе было несбалансированным. Лица с защищенной репрезентацией привязанности показали более высокий уровень агентности (например, внутренняя безопасная база, способности к ментализации) и связанность, тогда как незащищенно классифицированные люди продемонстрировали эти способности в меньшей степени (George and West, 2012).Следовательно, матери с ненадежной репрезентацией привязанности могут быть не в состоянии конструктивно размышлять о переживаниях, связанных с привязанностью, и полагаться на внутренние ресурсы на репрезентативном уровне. Это может объяснить, почему эти матери могут быть более уязвимыми по отношению к CM, что может привести к более низкой экспрессии белка OXTR. Однако эту связь следует интерпретировать с осторожностью из-за относительно небольшого размера выборки. В отличие от исследований, показывающих влияние представления прикрепления на систему OXT / OXTR, предыдущие исследования нашей группы показали противоположные результаты, в которых не было зависящих от прикрепления эффектов исходного уровня или уровней OXT в плазме у матерей, измеренных сразу после AAP (Krause et al., 2016). Таким образом, исследования системы OXT / OXTR у надежно и ненадежно прикрепленных лиц обнаружили противоречивые результаты, особенно если определялись уровни OXT в периферической плазме. Согласно нашим результатам, экспрессия белка OXTR может служить маркером долгосрочного прикрепления. В заключение мы приводим первые результаты измерения экспрессии белка OXTR в человеческих PBMC. Количественная оценка белка OXTR в PBMC может быть многообещающим инструментом для исследования и расширения нашего понимания роли системы OXT / OXTR в регуляции функционирования иммунных клеток, воспаления и стресс-реактивности в контексте CM.В результате жестокого обращения в детстве экспрессия белка OXTR, по-видимому, снижается в виде «шрама от жестокого обращения», который наблюдается даже спустя десятилетия после воздействия CM. Таким образом, дальнейшие исследования экспрессии белка OXTR в клеточных субпопуляциях иммунных клеток могут более подробно прояснить физиологические иммунные процессы, такие как высвобождение противовоспалительных цитокинов. Оценка OXTR в PBMC может быть новой мишенью биомаркера в исследованиях привязанности и травм. Авторские взносыI-TK, HG, AB, CW и AK разработали дизайн исследования. Вестерн-блот-анализы были разработаны SK, CB и AG вместе с AK. Компания AG провела анализ экспрессии белка и сбор исходных данных. Интервью AAP проводились KS и были классифицированы AB. Сбор биологических данных и интерпретация результатов были выполнены SK, CB и AG при существенной поддержке CW, I-TK и AK. Статистический анализ данных был выполнен ER и SK.SK написал первый черновик рукописи и отредактировал ее окончательную версию вместе с CW. Все авторы критически переработали рукопись на предмет важного интеллектуального содержания. Заявление о конфликте интересовАвторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов. БлагодарностиМы выражаем признательность экспериментальной группе исследования «Моё детство - твое детство», финансируемой BMBF (Bundesministerium für Bildung und Forschung).Дальнейшую финансовую поддержку оказали I-TK и HG. KS была поддержана стипендией Немецкого фонда академических стипендий, а CB - стипендией фонда Carl Zeiss. Мы хотели бы поблагодарить Траудла Хиллера за существенную помощь в выполнении заборов крови и за обработку образцов крови. Список литературыЭйнсворт, М. Д. С., Блехар, М. К., Уотерс, Э. и Уолл, С. (1978). Паттерны привязанности: психологическое исследование странной ситуации .Хиллсдейл, Нью-Джерси: Лоуренс Эрлбаум Ассошиэйтс. Google Scholar Бадер К., Ханни К., Шефер В., Нойкель А. и Куль К. (2009). Опросник по детским травмам - версия psychometrische eigenschaften einer deutschsprachigen. Z. Psychol. Psychother. 38, 223–230. DOI: 10.1026 / 1616-3443.38.4.223 CrossRef Полный текст | Google Scholar Бакерманс-Краненбург, М. Дж., И ван Эйзендорн, М. Х. (2013). Обнюхивание окситоцина: обзор и метаанализ испытаний в здоровых и клинических группах с последствиями для фармакотерапии. Пер. Психиатрия 3: e258. DOI: 10.1038 / tp.2013.34 PubMed Аннотация | CrossRef Полный текст | Google Scholar Бернштейн Д., Финк Л. (1998). Пособие по опроснику детской травмы . Нью-Йорк, Нью-Йорк: Психологическая корпорация. Бок К., Кениг А. М., Шури К., Гейгер М. Л., Карабациакис А., Уилкер С. и др. (2016). Воспаление у взрослых женщин с жестоким обращением с детьми в анамнезе: участие митохондриальных изменений и окислительного стресса. Митохондрия 30, 197–207. DOI: 10.1016 / j.mito.2016.08.006 PubMed Аннотация | CrossRef Полный текст | .История клетки: открытие клетки
Хотя внешне они очень разные, внутри слон, подсолнух и амеба состоят из одних и тех же строительных блоков. От отдельных клеток, составляющих самые основные организмы, до триллионов клеток, составляющих сложную структуру человеческого тела, каждое живое существо на Земле состоит из клеток. Эта идея, часть клеточной теории, является одним из центральных элементов биологии.Теория клеток также утверждает, что клетки являются основной функциональной единицей живых организмов и что все клетки происходят из других клеток. Хотя сегодня это знание является основополагающим, ученые не всегда знали о клетках.
Открытие клетки было бы невозможным, если бы не достижения в области микроскопа. Заинтересованный в изучении микроскопического мира ученый Роберт Гук в 1665 году улучшил конструкцию существующего составного микроскопа. В его микроскопе использовались три линзы и светильник, которые освещали и увеличивали образцы.Эти достижения позволили Гуку увидеть нечто удивительное, когда он поместил кусок пробки под микроскоп. Гук подробно рассказал о своих наблюдениях за этим крошечным и ранее невидимым миром в своей книге Micrographia . Для него пробка выглядела так, как если бы она была сделана из крошечных пор, которые он назвал «клетками», потому что они напоминали ему кельи в монастыре.
Наблюдая за клетками пробки, Гук отметил в Micrographia , что «я мог очень ясно представить, что она вся перфорированная и пористая, очень похожая на соты, но поры в ней нерегулярные… эти поры или клетки ... действительно были первыми микроскопическими порами, которые я когда-либо видел, и, возможно, когда-либо видел, потому что я не встречал ни одного Писателя или Человека, которые упоминали бы о них до этого ... »
Вскоре после открытия Гука голландский ученый Антони ван Левенгук обнаружил другие скрытые, крохотные организмы - бактерии и простейшие.Неудивительно, что ван Левенгук сделал такое открытие. Он был мастером в изготовлении микроскопов и усовершенствовал конструкцию простого микроскопа (у которого была только одна линза), что позволило ему увеличивать объект примерно в двести - триста раз от его первоначального размера. В эти микроскопы ван Левенгук увидел бактерии и простейшие, но он назвал этих крошечных существ «анималкулами».
Ван Левенгук был очарован. Он был первым, кто наблюдал и описывал сперматозоиды в 1677 году.Он даже взглянул на бляшку между зубами под микроскопом. В письме в Королевское общество он писал: «Тогда я почти всегда с большим удивлением видел, что в упомянутом вопросе было много очень маленьких живых животных, которые очень мило двигались».
В девятнадцатом веке биологи начали более пристально изучать ткани животных и растений, совершенствуя теорию клеток. Ученые легко могли сказать, что растения полностью состоят из клеток благодаря их клеточной стенке.Однако это было не так очевидно для клеток животных, у которых отсутствует клеточная стенка. Многие ученые считали, что животные состоят из «шариков».
Немецкие ученые Теодор Шванн и Маттиас Шлейден изучали клетки животных и растений соответственно. Эти ученые определили ключевые различия между двумя типами клеток и выдвинули идею о том, что клетки являются фундаментальными единицами как растений, так и животных.
Однако Шванн и Шлейден неправильно поняли, как растут клетки.Шлейден считал, что клетки «засеваются» ядром и растут оттуда. Точно так же Шванн утверждал, что клетки животных «кристаллизуются» из материала между другими клетками. В конце концов правду начали открывать другие ученые. Еще одна часть головоломки клеточной теории была определена Рудольфом Вирховым в 1855 году, который заявил, что все клетки генерируются существующими клетками.
На рубеже веков внимание начало смещаться в сторону цитогенетики, целью которой было связать изучение клеток с изучением генетики.В 1880-х годах Уолтер Саттон и Теодор Бовери были ответственны за определение хромосомы как центра наследственности, навсегда связав генетику и цитологию. Более поздние открытия еще больше подтвердили и укрепили роль клетки в наследственности, например, исследования Джеймса Уотсона и Фрэнсиса Крика по структуре ДНК.
Открытие клетки продолжало оказывать влияние на науку сто лет спустя, с открытием стволовых клеток, недифференцированных клеток, которым еще предстоит развиться в более специализированные клетки.Ученые начали получать эмбриональные стволовые клетки от мышей в 1980-х, а в 1998 году Джеймс Томсон выделил человеческие эмбриональные стволовые клетки и разработал клеточные линии. Его работа была затем опубликована в статье в журнале Science . Позже было обнаружено, что взрослые ткани, обычно кожа, могут быть перепрограммированы в стволовые клетки и затем образовывать другие типы клеток. Эти клетки известны как индуцированные плюрипотентные стволовые клетки. Стволовые клетки сейчас используются для лечения многих заболеваний, таких как болезнь Альцгеймера и болезни сердца.
Открытие клетки оказало гораздо большее влияние на науку, чем Гук мог когда-либо мечтать в 1665 году. Помимо того, что мы получили фундаментальное понимание строительных блоков всех живых организмов, открытие клетки привело к прогрессу в медицинские технологии и лечение. Сегодня ученые работают над персонализированной медициной, которая позволит нам выращивать стволовые клетки из наших собственных клеток, а затем использовать их для понимания процессов болезни. Все это и многое другое выросло из одного наблюдения клетки в пробке. . атипичных мононуклеарных клеток - определениеПример предложений с «атипичными мононуклеарными клетками», память переводовspringer Локализованное и неактивное заболевание, а также отсутствие атипичных мононуклеарных клеток в периферической крови оказали благоприятное влияние на долгосрочный рост in vitro. HrenWaCResearch Цели: Изучение морфологических, ультраструктурных, цитохимических, цитоферментных и иммунологических характеристик лимфоцитов и атипичных мононуклеарных клеток (АМК), их этиологии в крови и лимфоидных органах больных с синдромом инфекционного мононуклеоза различной этиологии.2.WikiMatrix Варианты: Клетка Ходжкина (атипичный мононуклеарный RSC) представляет собой вариант RS-клетки, которая имеет те же характеристики, но является мононуклеарной. Спрингер Как до, так и после операции CSF содержала несколько атипичных лимфоцитов и мононуклеарных клеток, одна из которых показала ультраструктурную глубоко расщепленное ядро клеток Сезари. Шприц. Уровни сывороточного иммуноглобулина, наличие циркулирующих аутоантител, количество периферических «атипичных» лимфоцитов и количество синтезирующих ДНК и РНК мононуклеарных клеток были изучены в группе «здоровых» HB-Ag (Австралия Antigen) и в группе здоровых субъектов отрицательного контроля HB-Ag.Показаны страницы 1. Найдено 6 предложения с фразой atypical mononuclear cells.Найдено за 2 мс.Накопители переводов создаются человеком, но выравниваются с помощью компьютера, что может вызвать ошибки. Найдено за 1 мс.Накопители переводов создаются человеком, но выравниваются с помощью компьютера, что может вызвать ошибки. Они поступают из многих источников и не проверяются. Имейте в виду. .Роль лептина в активации иммунных клетокЖировая ткань является активным эндокринным органом, который секретирует различные гуморальные факторы (адипокины), и ее сдвиг в производство провоспалительных цитокинов при ожирении, вероятно, способствует низкому уровню системного воспаления, которое может быть присутствует при хронических патологиях, связанных с метаболическим синдромом, таких как атеросклероз. Лептин - один из наиболее важных гормонов, секретируемых адипоцитами, с множеством физиологических функций, связанных с контролем метаболизма и энергетическим гомеостазом.Одна из этих функций - связь между статусом питания и иммунной компетентностью. Было показано, что гормон лептин, полученный из адипоцитов, регулирует иммунный ответ, врожденный и адаптивный ответ как в нормальных, так и при патологических состояниях. Роль лептина в регуляции иммунного ответа была оценена in vitro, а также в клинических исследованиях. Было показано, что условия пониженного производства лептина связаны с повышенной восприимчивостью к инфекции. Напротив, иммуноопосредованные расстройства, такие как аутоиммунные заболевания, связаны с повышенной секрецией лептина и выработкой провоспалительных патогенных цитокинов.Таким образом, лептин является медиатором воспалительной реакции. 1. ВведениеБелая жировая ткань играет очень важную роль в энергетическом балансе млекопитающих. Эта ткань специализируется на хранении липидов и снабжении топливом всего тела, когда это необходимо. Чтобы удовлетворить потребности в энергии, адипоциты регулируют мобилизацию жирных кислот в ответ на катаболические и анаболические стимулы. Однако жировая ткань - это не только резервный орган; это также эндокринный орган, способный выделять гормоны, пептиды и цитокины (адипокины), которые влияют как на энергетический статус, так и на иммунную систему [1].Лептин - один из наиболее важных гормонов, секретируемых жировой тканью [2], и его влияние на энергетический гомеостаз на центральном уровне подробно описано [3]. Вместо «сигнала голодания» лептин является сигналом голодания, поскольку падение концентрации лептина в сыворотке крови приводит к нейрогуморальным и поведенческим изменениям, пытаясь сохранить запасы энергии для жизненно важных функций. Таким образом, во время периода голодания и после уменьшения жировой массы тела наблюдается снижение уровня лептина, что приводит к снижению общих затрат энергии, чтобы обеспечить достаточное количество энергии для работы жизненно важных органов, то есть мозга, сердца и других органов. печень [4].Несмотря на то, что эти эффекты снижения лептина направлены на повышение шансов на выживание в условиях голода, падение уровня лептина может привести к подавлению иммунитета [5], в дополнение к другим нейроэндокринным изменениям, влияющим на надпочечники, щитовидную железу и сексуальную / репродуктивную функцию [6 ]. По крайней мере, эти изменения наблюдались во время голодания параллельно снижению уровня лептина в крови. Фактически, как мыши ob / ob (с отсутствием секреции лептина), так и мыши db / db (без рецептора лептина) не только страдают ожирением, но и демонстрируют иммунный / эндокринный дефицит, наблюдаемый во время голодания [5, 7].Более того, недавно было показано, что отмена лептина в течение 8 дней у экспериментальных животных приводит к таким же эффектам в отношении центрального контроля эндокринной системы, включая половую функцию [8]. Было обнаружено, что даже у людей уровни лептина связаны с иммунным ответом у недоедающих младенцев, у которых низкий уровень лептина в плазме и ослабленный иммунный ответ [9]. Более того, недостаточность передачи сигналов лептина нарушает гуморальные и клеточные иммунные ответы. Рецептор лептина Ob-Rb экспрессируется В- и Т-лимфоцитами, что позволяет предположить, что лептин непосредственно регулирует ответы В- и Т-клеток [10]. Модуляция лептином иммунной системы также опосредуется регуляцией гемопоэза и лимфопоэза [7, 11]. Таким образом, семь дней введения рекомбинантного лептина способствовали значительному лимфопоэзу с двукратным увеличением количества В-клеток в костном мозге. мышей с ожирением при удвоении и утроении, соответственно, количества пре-В и незрелых В-клеток. Двенадцать дней приема добавок привели эти субпопуляции к почти нормальным пропорциям. Лечение лептином также способствовало миелопоэзу, так что костный мозг мышей с ожирением содержал нормальное количество моноцитов и гранулоцитов через 7 дней [12]. Модуляция иммунной системы лептином проявляется на уровнях развития, пролиферации, антиапоптоза, созревания и активации [13]. Фактически рецепторы лептина были обнаружены в нейтрофилах, моноцитах и лимфоцитах, а рецептор лептина принадлежит к семейству рецепторов цитокинов класса I. Более того, лептин активирует сигнальные пути, аналогичные тем, которые задействованы другими членами семьи [14]. Общее действие лептина в иммунной системе представляет собой провоспалительный эффект, активируя провоспалительные клетки, способствуя ответам Т-хелпера 1 и опосредуя выработку других провоспалительных цитокинов, таких как фактор некроза опухоли α , интерлейкин (ИЛ) -2 , или Ил-6.Рецептор лептина также активируется провоспалительными сигналами. В этой статье мы обобщим данные из литературы, которые демонстрируют положительную регуляцию иммунного ответа лептином (рисунок 1) [14].  2. Активация лептином врожденного иммунитетаПервичная аминокислотная последовательность лептина указывает на то, что он может принадлежать к семейству длинноцепочечных спиральных цитокинов [15], таких как IL-2, IL-12 и GH. . Фактически, рецептор лептина (Ob-R) демонстрирует гомологию последовательностей с членами суперсемейства рецепторов цитокинов класса I (gp130) [16], которое включает рецептор IL-6, фактор ингибирования лейкоцитов (LIF) и фактор, стимулирующий колонию гранулоцитов ( G-CSF).Более того, было показано, что Ob-R обладает сигнальными способностями цитокиновых рецепторов IL-6-типа [16], активируя пути передачи сигналов JAK-STAT, PI3K и MAPK [14]. В этом контексте предполагается роль лептина в регуляции врожденного иммунитета [14, 17]. В соответствии с этой ролью лептина в механизмах иммунного ответа и защиты хозяина, уровни циркулирующего лептина повышаются при инфекционных и воспалительных стимулах, таких как ЛПС, скипидар и цитокины [18, 19]. С другой стороны, в отличие от других членов семейства IL-6, неясно, может ли лептин индуцировать экспрессию белков острой фазы, и были предоставлены противоречивые данные [19, 20].Роль лептина в регуляции врожденного иммунитета была рассмотрена ранее [6]. 2.1. Активация лептином моноцитов / макрофаговИсследования на грызунах с генетическими аномалиями в рецепторах лептина или лептина выявили связанные с ожирением дефициты фагоцитоза макрофагов и экспрессии провоспалительных цитокинов как in vivo, так и in vitro, тогда как экзогенный лептин усиливал как продукцию фагоцитоза, так и фагоцитоз. цитокины [21]. Кроме того, были обнаружены фенотипические нарушения в макрофагах лептин-дефицитных мышей с ожирением [22].Что еще более важно, дефицит лептина увеличивает восприимчивость к инфекционным и воспалительным стимулам и связан с нарушением регуляции продукции цитокинов [19]. Более конкретно, дефицит лептина у мышей изменяет продукцию цитокинов купферовскими клетками, которые регулируют врожденную иммунную систему. В этом контексте уровни лептина резко повышаются во время инфекции и воспаления и могут представлять собой защитный компонент ответа хозяина на воспаление [23]. Было обнаружено, что лептин человека стимулирует пролиферацию и активацию циркулирующих моноцитов человека in vitro, способствуя экспрессии маркеров активации: CD69, CD25, CD38 и CD71, в дополнение к увеличению экспрессии поверхностных маркеров моноцитов, таких как HLA-DR , CD11b и CD11c [24].Кроме того, лептин усиливает стимулирующее действие ЛПС или ФМА на пролиферацию и активацию моноцитов человека. Более того, лептин дозозависимо стимулирует продукцию провоспалительных цитокинов моноцитами, то есть TNF- и IL-6 [25], и усиливает экспрессию CC-хемокинового лиганда в культивируемых макрофагах мыши за счет активации пути JAK2-STAT3 [25]. . Также оценивали наличие обеих изоформ рецептора лептина. Позже было обнаружено, что лептин непосредственно индуцирует секрецию антагониста рецептора интерлейкина 1 в моноцитах человека [26] и активирует IP-10 (интерферон-гамма-индуцируемый белок) в моноцитарных клетках [27].Более того, в моноцитах человека было показано, что лептин увеличивает продукцию как свободных радикалов, так и холестерина, ингибируемых статинами, in vitro [28]. Кроме того, он ускоряет накопление холестерилового эфира в макрофагах, происходящих из моноцитов человека, за счет увеличения экспрессии ACAT-1 через JAK2 и PI3K, тем самым подавляя отток холестерина [29]. В альвеолярных макрофагах лептин усиливает синтез лейкотриенов [30]. Возможная роль лептина как трофического фактора для предотвращения апоптоза также была обнаружена в человеческих моноцитах с истощенной сывороткой [31], что еще раз подтверждает роль лептина как фактора роста моноцитов.Более того, лептин регулирует функцию моноцитов, что оценивается в экспериментах in vitro по измерению выработки свободных радикалов. Таким образом, было показано, что лептин стимулирует окислительный взрыв в контрольных моноцитах [32], а связывание лептина на поверхности макрофагальных клеток увеличивает экспрессию липопротеинлипазы посредством окислительного стресса и путей, зависимых от PKC. В этой линии было обнаружено, что лептин увеличивает окислительный стресс в макрофагах [33]. Наконец, лептин может действовать как хемоаттрактант моноцитов / макрофагов, вызывая in vitro максимальные хемотаксические реакции при концентрации 1 нг / мл [34], опосредуя воспалительный инфильтрат [35] и индуцируя экспрессию тканевого фактора в мононуклеарных клетках периферической крови человека [36].С другой стороны, лептин человека, по-видимому, подавляет окислительный взрыв в ранее активированных моноцитах [32]. Дендритные клетки принадлежат больше к одному и тому же клону клеток, чем к моноцитам / макрофагам, и также представляют рецепторы лептина (OBRb) на поверхности клетки [37]. Таким образом, было обнаружено, что лептин увеличивает продукцию IL-8, IL-12, IL-6 и TNF-, тогда как он снижает продукцию MIP-1- дендритными клетками. Подобно эффекту лептина на моноциты, он может увеличивать выживаемость дендритных клеток, а также может увеличивать экспрессию поверхностных молекул, таких как CD1a, CD80, CD83 или CD86.Лептин вызывает функциональные и морфологические изменения в дендритных клетках человека (ДК), направляя их в сторону Th2-примирования и способствуя выживанию ДК через сигнальный путь PI3K-Akt [38]. Участие передачи сигналов лептина в выживание и созревание ДК наблюдалось у мышей db / db с дефицитом рецептора лептина (Ob-R-). Мыши Db / db демонстрировали заметно сниженную экспрессию костимулирующих молекул и профиль цитокинов Th3-типа с низкой способностью стимулировать пролиферацию аллогенных Т-клеток. В соответствии с их нарушенным фенотипом и функцией DCs db / db демонстрировали значительно подавленную активность пути PI3K / Akt, а также STAT-3 и IkappaB-alpha.Более того, сниженные DCs, полученные в культуре костного мозга db / db, были приписаны значительному усилению апоптоза, который был связан с дисрегулируемой экспрессией генов семейства Bcl-2 [39]. Экспрессия лептина и рецепторов лептина была продемонстрирована на тучных клетках, что позволяет предположить паракринные и / или аутокринные иммуномодулирующие эффекты лептина на тучные клетки [40]. 2.2. Активация лептином нейтрофиловБыло обнаружено, что полиморфно-ядерные нейтрофилы человека (PMN) экспрессируют рецептор лептина in vitro и in vivo [41, 42].Однако Заркеш-Исфахани и др. [43] продемонстрировали, что нейтрофилы экспрессируют только короткую форму рецептора лептина, которой достаточно для передачи сигнала внутри клетки, усиления экспрессии CD11b и предотвращения апоптоза [42, 43]. Лептин задерживает расщепление Bid и Bax, высвобождение митохондриями цитохрома с и второго активатора каспазы, происходящего из митохондрий, а также активацию каспазы-8 и каспазы-3 в этих клетках [42]. Следовательно, лептин, по-видимому, ведет себя как цитокин выживания для PMN, аналогично G-CSF. Лептин способствует хемотаксису нейтрофилов [19, 44]. Фактически, эффект хемоаттрактанта сравним с эффектом хорошо известного формилметиониллейцилфенилаланина (FMLP). В противном случае, когда лептин действует как уремический токсин, он препятствует хемотаксису нейтрофилов [45] и ингибирует миграцию нейтрофилов в ответ на классические нейтрофильные хемоаттрактанты, а лептин наделен хемотаксической активностью по отношению к нейтрофилам. Две активности, ингибирование клеточного ответа на хемокины и стимуляция миграции нейтрофилов, могут быть обнаружены при аналогичных концентрациях.Напротив, нейтрофилы, подвергшиеся воздействию лептина, не проявляли детектируемой мобилизации [Ca2] i, продукции оксидантов или активации бета2-интегрина [46]. Более того, лептин также оказывает стимулирующее действие на внутриклеточную продукцию перекиси водорода в PMN, хотя этот эффект, по-видимому, опосредуется активацией моноцитов [42]. В частности, лептин модулирует фагоцитоз нейтрофилов Klebsiella pneumoniae [47], а у пациентов с диабетом повышение уровня лептина в сыворотке коррелирует со степенью экспрессии CD11b [48]. На эозинофилах лептин может повышать экспрессию на клеточной поверхности молекул адгезии ICAM-1 и CD18, но подавлять ICAM-3 и L-селектин. Более того, лептин может также стимулировать хемокинез эозинофилов и индуцировать высвобождение воспалительных цитокинов IL-1beta и IL-6 и хемокинов IL-8, связанного с ростом онкогена-альфа и MCP-1 [49]. 2.3. Природные киллерные (NK) клеткиЧеловеческие NK-клетки конститутивно экспрессируют как длинные, так и короткие формы рецептора Ob. Более того, рецепторы лептина могут передавать сигналы в NK-клетках, поскольку лептин активирует фосфорилирование STAT3 в NK-клетках.Более того, лептин увеличивает экспрессию генов IL-2 и перфорина на уровнях транскрипции в NK-клетках. В соответствии с этой ролью лептина, регулирующей NK-клетки, было обнаружено, что у мышей db / db нарушена функция NK-клеток [50, 51]. Действие лептина в NK-клетках включает созревание, дифференцировку, активацию и цитотоксичность [20]. Лептин усиливает как развитие, так и активацию NK-клеток [50], увеличивая уровень IL-12 и снижая экспрессию IL-15 [51]. Кроме того, лептин опосредует активацию NK-клеток опосредованно путем модуляции IL-1, IL-6 и TNF- моноцитами и макрофагами [36]. 3. Модуляция лептином адаптивного иммунного ответаРоль лептина в клеточном иммунитете была получена при работе с мышами ob / ob [18]. У этих мышей пониженная чувствительность Т-клеток к активирующим стимулам. Кроме того, у этих животных наблюдается атрофия лимфоидных органов [5–7] с уменьшением количества циркулирующих Т-клеток и увеличением количества моноцитов. Кроме того, у мышей ob / ob наблюдается снижение количества TNKCD4 в печени [52]. Способность лептина предотвращать атрофию тимуса обусловлена прямым антиапоптотическим действием на Т-клетки [7].Таким образом, лечение лептином увеличивает экспрессию в тимусе интерлейкина-7, важного растворимого фактора роста тимоцитов, продуцируемого медуллярными эпителиальными клетками тимуса (ТЭК). Гормон лептин играет интратимическую роль в поддержании здорового эпителия тимуса и стимулировании тимопоэза, что обнаруживается, когда гомеостаз тимуса нарушается эндотоксемией. В этом случае лечение лептином снижает in vivo апоптоз двойных положительных тимоцитов и способствует пролиферации двойных отрицательных тимоцитов [53]. В тимусе Fyn действует как тирозинкиназа, которая трансдуцирует сигнал лептина независимо от активации JAK2 и опосредует некоторые иммуномодулирующие эффекты лептина в этой ткани. Тирозинкиназа, Fyn, конститутивно связана с Ob-R в клетках тимуса. После стимула лептином, Fyn претерпевает активирующее фосфорилирование тирозина и временную ассоциацию с IRS1 [54]. Острый дефицит лептина оказывает сильное влияние на иммунную систему, которое даже выше, чем у мышей ob / ob (генетический дефект).У мышей с острой гиполептинемией наблюдается более высокое снижение общего количества тимоцитов и вдвое большее количество апоптотических клеток, чем у мышей ob / ob. Более того, острый дефицит лептина также вызывает снижение клеточности селезенки, чего не происходит у мышей ob / ob, даже если у них селезенка меньше, чем у контрольных мышей [8]. У мышей ob / ob и db / db обнаруживаются дефекты клеточно-опосредованного иммунного ответа, которые приводят к нарушенной реакции замедленной гиперчувствительности, подавлению отторжения кожного аллотрансплантата и ингибированию отека подушечек стопы отзывающими антигенами [6, 55–57].В недавних исследованиях лептин усиливал пролиферацию лимфоцитов in vivo у сибирских хомяков ( Phodopus sungorus ) и увеличивал пролиферацию спленоцитов у мышей [58], а также увеличивал процент Т-клеток, особенно CD4 Th-клеток, в перитонеальной жидкости пациентов с эндометриозом. [59]. Lord et al. 1998 [5], продемонстрировали, что лимфоциты мыши экспрессируют длинную форму рецептора лептина, и что лептин модулирует продукцию цитокинов в этих клетках. Кроме того, лептин также регулирует количество и активацию Т-лимфоцитов.Пролиферативный ответ на лептин у мышей, по-видимому, вырабатывается наивными Т-клетками (CD4CD45RA), тогда как было показано, что лептин ингибирует пролиферацию Т-клеток памяти (CD4CD45RO) [5]. Лептин обеспечивает сигнал выживания в дважды положительных Т-клетках (CD4CD8) и простых положительных CD4 + CD8 тимоцитах во время созревания тимуса [7]. Кроме того, лептин способствует экспрессии молекул адгезии в CD4 + Т-клетках, таких как VLA-2 (CD49b) или ICAM-1 (CD54) [5, 18]. Совсем недавно мы рассмотрели роль лептина человека в ответе Т-клеток [14].Лептин человека сам по себе не способен активировать лимфоциты периферической крови человека in vitro [23], хотя рецептор лептина присутствует и активируется в Т-лимфоцитах при стимуляции лептином, полностью запуская передачу внутриклеточного сигнала, как мы также оценили [60, 61]. Однако, когда Т-лимфоциты костимулируются с помощью ФГА или конканавалина А (Con A), лептин дозозависимо усиливает пролиферацию и активацию культивируемых Т-лимфоцитов, достигая максимального эффекта при концентрации 10 нМ [62].Таким образом, лептин увеличивает экспрессию маркеров ранней активации, таких как CD69, а также экспрессию маркеров поздней активации, таких как CD25 или CD71, в Т-лимфоцитах CD4 и CD8 в присутствии субоптимальных концентраций активаторов, таких как ФГА (2 г / мл) и после стимуляции ФМА-иономицином [63]. Однако, когда используются максимальные концентрации PHA или Con A, лептин не оказывает дальнейшего воздействия. Эти эффекты лептина на Т-лимфоциты наблюдаются даже в отсутствие моноцитов, что свидетельствует о прямом влиянии лептина человека на циркулирующие Т-лимфоциты при их костимуляции [62].Активация Т-клеток вызывает экспрессию длинной изоформы рецептора Ob [63]. Необходимость костимуляции митогенами для получения эффекта лептина в лимфоцитах может быть частично объяснена этим эффектом активации, увеличивая экспрессию рецептора лептина в Т-лимфоцитах. Кроме того, эти данные свидетельствуют о том, что рецептор лептина может регулироваться аналогично другим рецепторам цитокинов, таким как рецептор IL-2 (CD25). Лептин человека не только модулирует активацию и пролиферацию Т-лимфоцитов человека, но также усиливает продукцию цитокинов, вызванную субмаксимальными концентрациями ФГА [62].Таким образом, лептин человека усиливает продукцию ИЛ-2 и ИФН- в стимулированных Т-лимфоцитах. Ранее на мышах было показано, что лептин может усиливать ответ родственных Т-клеток, искажая ответы цитокинов в сторону фенотипа Th2 у мышей [5]. Эти данные согласуются с наблюдением за эффектом лептина на анти-CD3-стимуляцию Т-клеток, что увеличивает продукцию провоспалительного цитокина IFN- [64]. Эффект лептин-поляризующих Т-клеток на ответ Th2, по-видимому, опосредован стимуляцией синтеза IL-2, IL-12 и IFN-гамма и ингибированием продукции IL-10 и IL-4 [36, 62 ].Поляризация Th2 коррелирует с гиперлептинемией у пациентов, находящихся на гемодиализе [65], а защита мышей ob / ob при Th2- и Th3-зависимом воспалении обеспечивается сниженной экспрессией ключевых факторов транскрипции для поляризации Th2 и Th3, T -bet и GATA-3 в наивных ob / ob Т-клетках. В этом случае было обнаружено, что лептин необходим в T-helper 1- (Th2-) зависимых воспалительных процессах, выступая в качестве критического регулятора поляризации CD4 T-клеток in vitro и in vivo [66]. Эти данные, касающиеся модуляции лептином продукции цитокинов Th2-типа, согласуются с наблюдаемыми эффектами лептина, стимулирующего выработку TNF- и IL-6 моноцитами [24], что дополнительно указывает на возможную роль лептина человека в регуляции иммунной системы, вызывающей провоспалительный ответ.На мононуклеарные клетки периферической крови пациентов с анкилозирующим спондилитом лептин оказывает провоспалительное действие [67], а также усиливает провоспалительные цитокины в нормальных колоноцитах и в колоноцитах опухоли с ксенотрансплантатом HT29. Продукты, полученные из колоноцитов, после обработки лептином стимулировали экспрессию перфорина и гранзима B в нормальных CD8 () Т-клетках in vitro [68]. Кроме того, лептин сам по себе или в комбинации с IL-1 увеличивал экспрессию iNOS и COX-2 и продукцию NO, PGE (2), IL-6 и IL-8.Действие лептина опосредуется активацией фактора транскрипции ядерного фактора-kappaB (NF-kappaB) и митоген-активируемой протеинкиназы (MAPK) пути c-Jun NH (2) -концевой киназы (JNK). Повышенный синтез провоспалительных медиаторов опосредуется оксидом азота (NO) в хрящах остеоартрита человека [69]. С другой стороны, лептин способствует выживанию Т-клеток и выживанию Т-лимфоцитов Jurkat [70], модулируя экспрессию антиапоптотических белков, таких как Bcl-xL, при стресс-индуцированном апоптозе [71].Этот трофический эффект лептина на Т-клетки согласуется со снижением количества лимфоцитов, наблюдаемым у голодных мышей, что может быть объяснено резким снижением уровня лептина [7, 19]. Роль лептина, модулирующего функцию Т-лимфоцитов у людей, окончательно определена клиническими исследованиями в конкретных и редких случаях пациентов с моногенным ожирением. При ожирении у людей из-за врожденного дефицита лептина наблюдается гипореактивность Т-лимфоцитов (в дополнение к ожидаемой нейроэндокринной / метаболической дисфункции), и не только лечение лептином у этих пациентов является эффективным средством снижения массы тела, но также может вернуть Т-клеточный ответ на активация митогена in vitro [72].Кроме того, лептин был необходим у недолетних (≥90 лет) для поддержания функциональных наивных Т-лимфоцитов CD8 и здоровой иммунной системы [73]. Рецептор лептина сильно экспрессируется на клеточной поверхности Treg. Лептин может действовать как негативный сигнал для пролиферации человеческих Foxp3 () CD4 () CD25 () регуляторных T (T (reg)) клеток. In vitro нейтрализация моноклональным антителом к лептину (mAb) во время стимуляции анти-CD3 и анти-CD28 приводила к пролиферации T (reg) клеток, которая была зависимой от интерлейкина-2 (IL-2).Вместе с обнаружением повышенной пролиферации T (reg) -клеток, наблюдаемой у мышей с дефицитом лептина и ObR, эти результаты предполагают возможность терапевтического вмешательства при иммунных и аутоиммунных заболеваниях [74]. 4. ВыводыВ заключение, лептин играет роль в активации иммунной системы и является медиатором воспаления. В этом контексте лептин может быть одним из медиаторов, ответственных за системное воспаление низкого уровня, которое может присутствовать при хронических патологиях, связанных с метаболическим синдромом, таких как атеросклероз, связанный с ожирением, особенно центральным ожирением.Следовательно, лептин можно рассматривать как терапевтическую мишень в некоторых клинических ситуациях, таких как провоспалительные состояния или аутоиммунные заболевания, для контроля избыточного иммунного ответа, а также в других клинических ситуациях, таких как голодание, для контроля избыточных физических нагрузок. или иммунодефицит, чтобы улучшить нарушенный иммунный ответ. Вот почему изучение роли лептина в регуляции иммунного ответа остается проблемой на будущее. . |
||||||||||||||||
| © 2008- Кафедра педиатрии имени профессора И.М. Воронцова ФП и ДПО. Содержание, карта. | ||||||||||||||||